题目内容
【题目】黄铜矿(主要成分 CuFeS2)经初步处理后,所得溶液中的溶质为Fe2(SO4)3、CuSO4及 H2SO4 . 某同学通过废铁屑与所得溶液反应,制取还原铁粉并回收铜. 主要步骤如图所示: 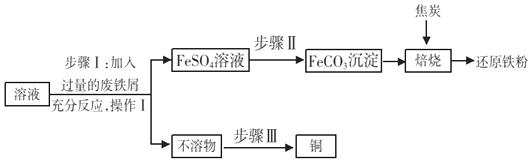
(1)Fe2(SO4)3与铁反应的化学方程式:x Fe2(SO4)3+y Fe═z FeSO4 , 其中 x、y、z 为化学计量数,z 的值为 .
(2)操作Ⅰ的名称是 , 此操作中起到引流作用的仪器是 .
(3)步骤Ⅰ中,生成铜的化学方程式: .
(4)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是 .
(5)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是(填化学式).
(6)隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3 ![]() FeO
FeO ![]() Fe, 实际作还原剂的是 CO. 写出“焙烧”过程中各步反应的化学方程式:
Fe, 实际作还原剂的是 CO. 写出“焙烧”过程中各步反应的化学方程式:
①FeCO3 ![]() FeO+CO2↑
FeO+CO2↑
②.
【答案】
(1)3
(2)过滤;玻璃棒
(3)Fe+CuSO4=Cu+FeSO4 .
(4)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe═FeSO4 .
(5)Na2CO3等可溶性碳酸盐(答案不为一)
(6)FeO+CO ![]() Fe+CO2 .
Fe+CO2 .
【解析】解:(1)Fe2(SO4)3与铁反应的化学方程式:x Fe2(SO4)3+y Fe═z FeSO4 , 根据质量守恒定律配平后为:Fe2(SO4)3+2 Fe═3 FeSO4 , 其中 x=1、y=2、z=3,所以z 的值为 3.(2)操作Ⅰ是固体和液体分离的操作,为过滤,此操作中起到引流作用的仪器是 玻璃棒.(3)步骤Ⅰ铁屑和硫酸铜能够反应生成铜和硫酸亚铁,此处要求书写的是生成铜的反应,一定要留意题目的答题要求.对应的化学方程式:Fe+CuSO4=Cu+FeSO4 . (4)步骤Ⅰ中,废铁屑含有少量铁锈,由于铁锈和硫酸反应生成硫酸铁和水,而硫酸铁和铁能够生成硫酸亚铁,所以对产物的成分没有影响.对应的化学方程式为 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe═FeSO4 . 此处回答为语言描述或者化学方程式都可以.(5)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析.由于提示是从复分解反应发生的条件分析,说明该反应为复分解反应,而反应物硫酸亚铁,对应的生成物为碳酸亚铁,说明反应物含有碳酸盐或者是碳酸(一般没有用碳酸做反应物的,因为其不稳定,不便于储存和运输等).由于复分解反应中反应物需要满足“有酸可不溶,无酸需都溶“.而硫酸亚铁是可溶性盐,所以加入的碳酸盐也应该是可溶,所以该试剂可以是 Na2CO3等可溶性碳酸盐(填化学式).(6)②是生成的氧化亚铁和实际做还原剂的CO反应生成铁和二氧化碳,对应的化学方程式为:FeO+CO ![]() Fe+CO2 . 所以答案是:(1)3.(2)过滤;玻璃棒.(3)Fe+CuSO4=Cu+FeSO4 . (4)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe═FeSO4 . (5)Na2CO3等可溶性碳酸盐(答案不为一).(6)FeO+CO
Fe+CO2 . 所以答案是:(1)3.(2)过滤;玻璃棒.(3)Fe+CuSO4=Cu+FeSO4 . (4)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe═FeSO4 . (5)Na2CO3等可溶性碳酸盐(答案不为一).(6)FeO+CO ![]() Fe+CO2 .
Fe+CO2 .
【考点精析】根据题目的已知条件,利用过滤操作的注意事项和金属材料的选择依据的相关知识可以得到问题的答案,需要掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.

 阅读快车系列答案
阅读快车系列答案