题目内容
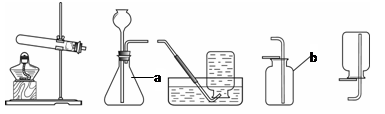
下图所示的装置是实验室常用来制取和收集气体的装置。

(1)写出仪器a和b的名称:a ,b ;如果选择实验装置A和F组合,用氯酸钾和二氧化锰来制取氧气,反应的方程式为 ,加热时试管口为什么应略向下倾斜 。
(2)某同学打算用大理石和稀盐酸制取二氧化碳,他选择了装置B和E连接,当稀盐酸和大理石都加入装置B一段时间后,他用燃着的火柴在E的瓶口试验,火柴仍然燃烧,你认为原因可能是 。
(3)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应生成氢氧化钠和氧气。用该反应来制取一瓶氧气,应选择的实验装置是 (填字母编号)。反应方程式为 。

(1)写出仪器a和b的名称:a ,b ;如果选择实验装置A和F组合,用氯酸钾和二氧化锰来制取氧气,反应的方程式为 ,加热时试管口为什么应略向下倾斜 。
(2)某同学打算用大理石和稀盐酸制取二氧化碳,他选择了装置B和E连接,当稀盐酸和大理石都加入装置B一段时间后,他用燃着的火柴在E的瓶口试验,火柴仍然燃烧,你认为原因可能是 。
(3)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应生成氢氧化钠和氧气。用该反应来制取一瓶氧气,应选择的实验装置是 (填字母编号)。反应方程式为 。
(1)酒精灯,集气瓶; 2KClO3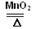 2KCl+3O2↑
2KCl+3O2↑
防止不干燥药品加热时产生的水蒸气在管口遇冷凝聚成水滴倒流,使试管破裂。
(2)CO2已经从长颈漏斗上口进入空气中
(3)C和E(或C和F); 2Na2O2 + 2H2O=4NaOH + O2↑。
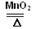 2KCl+3O2↑
2KCl+3O2↑ 防止不干燥药品加热时产生的水蒸气在管口遇冷凝聚成水滴倒流,使试管破裂。
(2)CO2已经从长颈漏斗上口进入空气中
(3)C和E(或C和F); 2Na2O2 + 2H2O=4NaOH + O2↑。
(1)酒精灯和集气瓶都是比较常见的仪器,加热时试管口为什么应略向下倾斜是防止不干燥药品加热时产生的水蒸气在管口遇冷凝聚成水滴倒流,使试管破裂。(2)长颈漏斗没有浸入液面一下,生成的二氧化碳通过长颈漏斗进入空气中,所以E装置收集不到纯净的二氧化碳,(3)过氧化钠和水在常温下反应,所以选择C装置,收集氧气可以用排水法和向上排空气法。

练习册系列答案
相关题目