题目内容
铜和铁是生产、生活中广泛使用的金属.(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁),反应的化学方程式为:
(2)铁生锈的条件是
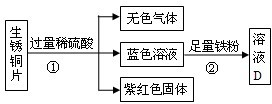
(3)老师用生锈的铜片,铁粉和稀硫酸进行实验,实验过程如图所示(部分生成物已略去).
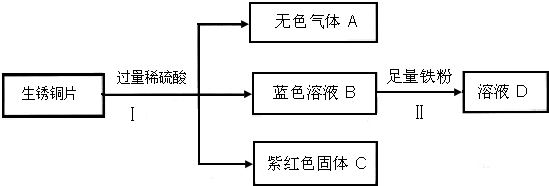
①紫红色固体C的化学式为
②写出Ⅱ中反应的化学方程式
分析:铁制品生锈是铁、氧气和水共同作用的结果,在金属活动性顺序中,只有氢前的金属可以和稀酸溶液反应生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,根据这一规律可以判断某些反应的发生.
解答:解:(1)由于一氧化碳具有还原性,在高温条件下,可以把氧化铁还原成铁,故答案为:3CO+Fe2O3
2Fe+3CO2
(2)由于铁制品生锈的实质是铁和氧气、水共同作用的结果,因此铁制品容易在潮湿的空气中生锈,碱式碳酸铜有四种元素组成,故答案为:与潮湿空气接触,4
(3)①由于生锈的铜片中有碱式碳酸铜和铜,因此向铜片中加入过量的稀硫酸时,铜并不和稀硫酸反应,而碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳气体,因此紫红色固体C是金属铜,故答案为:Cu
②由于稀硫酸是过量的,因此得到的蓝色溶液是硫酸铜和硫酸的混合溶液,故答案为:Fe+CuSO4=FeSO4+Cu;Fe+H2SO4=FeSO4+H2↑
| ||
(2)由于铁制品生锈的实质是铁和氧气、水共同作用的结果,因此铁制品容易在潮湿的空气中生锈,碱式碳酸铜有四种元素组成,故答案为:与潮湿空气接触,4
(3)①由于生锈的铜片中有碱式碳酸铜和铜,因此向铜片中加入过量的稀硫酸时,铜并不和稀硫酸反应,而碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳气体,因此紫红色固体C是金属铜,故答案为:Cu
②由于稀硫酸是过量的,因此得到的蓝色溶液是硫酸铜和硫酸的混合溶液,故答案为:Fe+CuSO4=FeSO4+Cu;Fe+H2SO4=FeSO4+H2↑
点评:本题难度不是很大,主要考查了对金属活动性顺序的应用,从而培养学生的理解能力和应用能力.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目