题目内容
【题目】碳和碳的化合物是初中化学学习的重要内容。
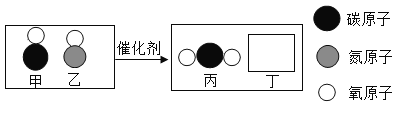
(1)金刚石、石墨和C60都是由碳元素组成的单质,下列有关说法正确的___(填字母代号)。
A 都是黑色固体 B 硬度相同
C 完全燃烧都生成二氧化碳 D 碳原子的排列方式相同
(2)碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
①如何检验一瓶碳酸钠溶液中是否混有氢氧化钠?请简要写出实验步骤、现象和结论。_________。
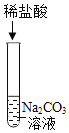
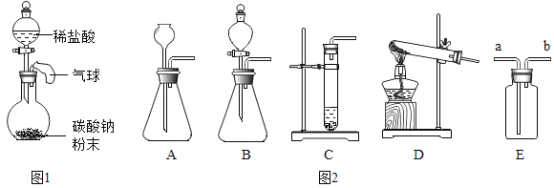
②如图1所示是某趣味实验装置图,其气密性良好。打开分液漏斗的活塞后,可观察到气球胀大的现象。请用化学方程式解释产生此现象的原因。____________
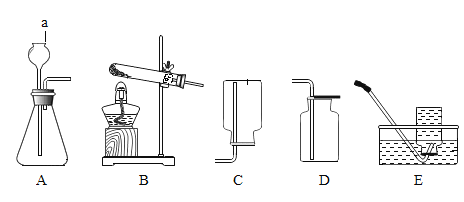
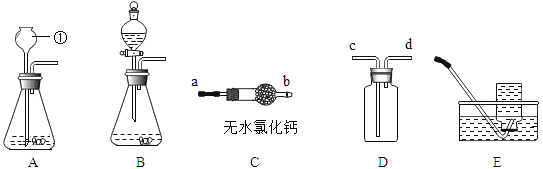
(3)如图2是实验室中制取气体常用到的仪器,请回答下列问题:
①请写出用D装置制取氧气的化学方程式______________________________。
②实验室可用碳化钙(CaC2)固体和水反应来制取乙炔气体,该反应必须严格控制加水的速率,以免剧烈反应放热引起发生装置炸裂,则制取乙炔的最适合发生装置是__;若用E装置采用排水法来收集乙炔,请简述操作步骤。_________
(4)乙炔(C2H2)是一种重要的化工原料。常用碳化钙(CaC2)与水反应制取乙炔,同时生成氢氧化钙。若要制取6.5g乙炔气体,理论上需要碳化钙的质量是多少?____________
【答案】C 取少量溶液于试管中,向试管中加入过量CaCl2溶液,过滤,再向滤液中滴加酚酞溶液,若滤液变红,则证明有NaOH,若滤液不变色,则证明无NaOH ![]()
 B 先将集气瓶装满水,收集乙炔时,从b端通入,将水从a端排出 16g
B 先将集气瓶装满水,收集乙炔时,从b端通入,将水从a端排出 16g
【解析】
(1)金刚石、石墨和C60都是由碳元素组成的单质,但由于碳原子的排列方式不同,其物理性质差异较大。金刚石是无色透明的,石墨是灰黑色的,C60在室温下为紫红色;金刚石硬度大,石墨质软。三种物质都是由碳元素组成的,所以完全燃烧都生成二氧化碳,故选C。
(2)取少量溶液于试管中,向试管中加入过量CaCl2溶液,CaCl2会与Na2CO3反应生成CaCO3沉淀和NaCl,过滤,再向滤液中滴加酚酞溶液,若滤液变红,则证明有NaOH,若滤液不变色,则证明无NaOH。稀盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,化学方程式为:![]() 。
。
(3)D装置是固体加热发生装置,试管口没有棉花,实验室可采用加氯酸钾和二氧化锰来制取氧气,化学方程式为: ;实验室可用碳化钙(CaC2)固体和水反应来制取乙炔气体,该反应必须严格控制加水的速率,以免剧烈反应放热引起发生装置炸裂,所以选取B装置,分液漏斗可控制加水速率。若用E装置采用排水法来收集乙炔,先将集气瓶装满水,收集乙炔时,从b端通入,将水从a端排出。
;实验室可用碳化钙(CaC2)固体和水反应来制取乙炔气体,该反应必须严格控制加水的速率,以免剧烈反应放热引起发生装置炸裂,所以选取B装置,分液漏斗可控制加水速率。若用E装置采用排水法来收集乙炔,先将集气瓶装满水,收集乙炔时,从b端通入,将水从a端排出。
(4)设需要碳化钙的质量是x。

故需要碳化钙的质量是16g。

 名师指导期末冲刺卷系列答案
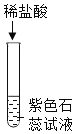
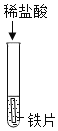
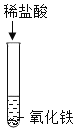
名师指导期末冲刺卷系列答案【题目】为探究酸的化学性质,某化学小组利用盐酸进行了如下实验操作,请回答
实验 |
A |
B |
C |
D |
E |
(1)A试管中的实验现象为___。写出图中C反应的化学方程式____。
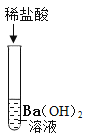
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行如下探究:
(提出问题)滤液中溶质的成分是什么?
(作出猜想)
猜想一:NaCl
猜想二:NaCl和BaCl2
猜想三:NaCl、BaCl2和Na2CO3
猜想四:____。
(进行讨论)经过讨论,同学们一致认为猜想三是错误的.请用化学方程式解释其错误的原因_____________________。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
取少量滤液于试管中,滴加稀硫酸 | ___ | 猜想四成立 |
(反思拓展)在分析反应后所得物质的成分时,除考虑生成物外还需考虑___。
【题目】控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )
|
|
|
|
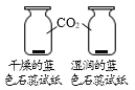
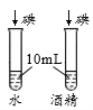
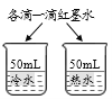
A.探究铁、镁金属活动性强弱 | B.探究二氧化碳与水是否发生反应 | C.探究不同溶剂中物质溶解性大小 | D.探究温度对分子运动快慢的影响 |
A. AB. BC. CD. D