题目内容
【题目】在20℃时,将氯化钙和氯化钾的混合物16.2克,放入36.2克水中使其完全溶解,然后加入27.6克溶质质量分数为50%的碳酸钾溶液,恰好完全反应。(假设在实验过程中温度保持不变)已知20℃时氯化钾的溶解度为34.0克。请计算:反应后所得溶液中溶质的质量分数。(精确到0.1%)
【答案】25.4%
【解析】
反应后所得溶液为氯化钾溶液,根据20℃时氯化钾的溶解度为34.0克,需要判断反应后氯化钾是否可以完全溶解,根据所溶解的氯化钾的质量计算反应后所得溶液中溶质的质量分数。
K2CO3的质量=27.6g×50%=13.8g,设混合物中CaCl2的质量为x,生成的KCl的质量为y,
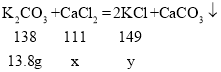
![]() ,
, ![]() ,
,
![]() ,
, ![]() ,
,
KCl的总质量为14.9g+16.2g-11.1g=20g,H2O的总质量为36.2g+27.6g×50%=50g,50g水最多能溶解17g KCl,所得溶液为饱和溶液,所以所得溶液中溶质的质量分数=![]() ;
;
答:所得溶液中溶质的质量分数为25.4%。

练习册系列答案
相关题目