题目内容
【题目】人类的生活和生产都离不开金属。
(1)铝和铜常用于制造导线,是利用了铝和铜的_____________性。
(2)世界上每年钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟___________等物质作用的结果。试举一种能防止铁器锈蚀的方法_______________;铝热剂是修建铁路时常用的焊接材料,其反应原理是在高温下,铝与氧化铁反应得到熔融的铁与一种氧化物,该反应的化学方程式为_________________。
(3)向两份等质量、等溶质质量分数的稀硫酸中分别加入等质量的锌粉和铁粉,生成氢气质量与反应时间的关系如图所示。下列说法错误的是_______。
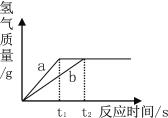
A.a为锌,b为铁
B.两份溶液中的硫酸一定都反应完
C.铁、锌一定都有剩余
D.反应掉的铁和锌的质量比为56∶65
【答案】 导电性 氧气和水 喷漆 2Al+Fe2O3 ![]() 2Fe+Al2O3 C
2Fe+Al2O3 C
【解析】(1)铝和铜都能导电都可制导线;
(2)铁生锈的条件是铁与水、氧气同时接触;防锈的方法使其与氧气、水隔绝,可涂保护膜或涂油等。铝粉与氧化铁在高温条件下反应的反应物是铝和氧化铁,生成物是铁和氧化铝,反应的化学方程式为:2Al+Fe2O3 ![]() 2Fe+Al2O3;
2Fe+Al2O3;
(3)A、锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短,故正确;
B、置换反应是金属置换酸中的氢元素,所以若生成的氢气的质量相等,硫酸均反应完,故正确;
C、由图示可知:生成的氢气的质量相等,所以硫酸均反应完;由方程式分析,二者反应结束后,可能金属都有剩余,也可能锌恰好反应完,铁有剩余,故错误;
D、根据化学方程式Fe+H2SO4═FeSO4+H2↑,可知每56g铁生成2g氢气,根据化学方程式Zn+H2SO4═ZnSO4+H2↑,可知每65g锌反应生成2g氢气;由于生成氢气相同,反应掉的铁和锌的质量比为56∶65,故正确。

 阅读快车系列答案
阅读快车系列答案