题目内容
在电缆生产过程中会产生一定量的含铜废料.据报道,在通入空气并加热的条件下,铜与稀硫酸反应转化为硫酸铜.(1)请完成该反应的化学方程式.2Cu+2H2SO4+O2
| ||
(2)若选用的稀硫酸溶质的质量分数为19.6%,则用100mL98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸,需加水
(3)取200g上述稀释后的硫酸与铜恰好完全反应,假定硫酸不和其他杂质反应,则反应后所得溶液的溶质质量分数是多少?
分析:(1)根据质量守恒定律进行分析;
(2)根据溶液稀释前后,溶质的质量不变进行分析;
(3)根据方程式就算出生成物的质量,然后根据质量分数的解法进行分析.
(2)根据溶液稀释前后,溶质的质量不变进行分析;
(3)根据方程式就算出生成物的质量,然后根据质量分数的解法进行分析.
解答:解:(1)根据质量守恒定律可知,在化学反应前后,原子的个数和元素的种类不变,反应前有氢元素,反应后也必须有氢元素,故答案为:2H2O;
(2)设需要加水为x,根据溶质质量不变得,
100×1.84×19.8%=(100×1.84+X)×19.6%
X=736克,
故答案为:736g,
(3)设生成硫酸铜的质量为x,水的质量为y,
2Cu+2H2SO4+O2
2CuSO4+2H2O
196 320 36
200×19.6% x y
=
=
x=64g,y=7.2g
溶质是硫酸铜,溶剂包括硫酸中的水和生成的水,
溶质=64克,溶剂等于7.2+200×80.4%=160.8+7.2=168克
溶质质量分数=
×100%=27.6%,
答:所得溶液溶质质量分数是27.6%.
(2)设需要加水为x,根据溶质质量不变得,
100×1.84×19.8%=(100×1.84+X)×19.6%
X=736克,
故答案为:736g,
(3)设生成硫酸铜的质量为x,水的质量为y,
2Cu+2H2SO4+O2
| ||
196 320 36
200×19.6% x y
| 196 |
| 200×19.6% |
| 320 |
| X |
| 36 |
| Y |
x=64g,y=7.2g
溶质是硫酸铜,溶剂包括硫酸中的水和生成的水,
溶质=64克,溶剂等于7.2+200×80.4%=160.8+7.2=168克
溶质质量分数=
| 64 |
| 64+168 |
答:所得溶液溶质质量分数是27.6%.
点评:在解此类题时,首先根据反应原理写出方程式,然后再根据方程式中的比例关系计算溶质和溶剂的质量,最后计算质量分数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
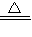 2CuSO4+______
2CuSO4+______