题目内容
【题目】根据下列装置,结合所学化学知识回答下列问题. 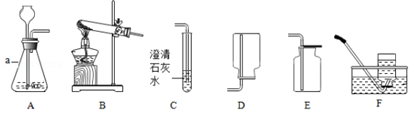
(1)写出仪器a的名称 .
(2)实验室用高锰酸钾制取氧气时,选择的发生装置是(填字母序号), 发生反应的化学方程式为 , 若选用E装置 收集氧气,验满的方法是 .
(3)用A装置制取了某气体,将其通入到C装置中澄清石灰水变浑浊,请写出C中发生反应的化学方程式 .
【答案】
(1)锥形瓶
(2)B;2KMnO4 ![]() K2MnO4+MnO2+O2↑;将一带火星的木条伸到集气瓶口,若木条复燃,证明已满.(操作、现象、结论缺一不可)
K2MnO4+MnO2+O2↑;将一带火星的木条伸到集气瓶口,若木条复燃,证明已满.(操作、现象、结论缺一不可)
(3)CO2+Ca(OH)2═CaCO3↓+H2O
【解析】解:(1)锥形瓶是常用的反应容器,所以答案是:锥形瓶;(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;所以答案是:B; 2KMnO4 ![]() K2MnO4+MnO2+O2↑;将一带火星的木条伸到集气瓶口,若木条复燃,证明已满.(操作、现象、结论缺一不可)(3)二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;所以答案是:CO2+Ca(OH)2═CaCO3↓+H2O;
K2MnO4+MnO2+O2↑;将一带火星的木条伸到集气瓶口,若木条复燃,证明已满.(操作、现象、结论缺一不可)(3)二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;所以答案是:CO2+Ca(OH)2═CaCO3↓+H2O;
【考点精析】掌握氧气的检验和验满和书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道氧气的验满:用带火星的木条放在集气瓶口;检验:用带火星的木条伸入集气瓶内;注意:a、配平 b、条件 c、箭号.

【题目】“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
甲 | 乙 | 丙 | |
烧杯+稀盐酸质量 | 139g | 129g | 129g |
加入黄铜样品质量 | 20g | 24g | 20g |
充分反应后,烧杯+剩余物质质量 | 158.8g | 152.8g | 148.8g |
请回答下列问题:
(1)同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是 .
(2)计算黄铜样品中锌的质量分数.
(3)完全反应后,所得溶液的溶质质量分数为多少?