题目内容
【题目】(一)我们知道二氧化碳与水反应生成碳酸,那么二氧化硫与水是否也能反应生成一种酸呢?某实验小组对此进行探究,设计的探究过程如下。请你回答其中的有关问题:
(1)做出假设:_______________________;
(2)设计方案:先验证水能否使蓝色石蕊试纸变色,再验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色,最后验证二氧化硫气体能否使湿润的蓝色石蕊试纸变红,实验装置和药品如图:
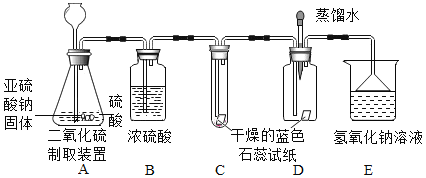
(3)查阅资料:你认为该实验小组需要掌握的资料内容中应包括(填序号)_________
①二氧化硫易溶于水 ②酸能使湿润的蓝色石蕊试纸变红 ③SO2不与浓硫酸反应 ④二氧化硫有毒,能与碱溶液反应生成盐和水
(4)实验:
①实验过程中装置C内石蕊试纸的颜色始终没有变化,这说明__________________。
②装置D中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红。此现象说明_________________,此过程中反应的化学方程式为______________________。
③装置E的作用是_____________________。
(5)结论:原假设_______________ (“成立”或“不成立”)。
(二)皮蛋是我国传统的蛋制品,深受人们喜爱,由少量 NaCl,CaO 和过量的 Na2CO3 混合得到的粉末状混合物 A 是制皮蛋的配方之一。
(1)某化学兴趣小组从市场获取少量的混合物 A 于烧杯中,缓慢加入足量的蒸馏水,边加边搅拌,静置,过滤得滤液。滤液中含有 Cl- 、OH- ,还含有的阴离子是__________ 。
(2)在混合物A中加入少量的ZnSO4可改善皮蛋品质,该兴趣小组获得某样品,探究混合物中是否添加了少量的 ZnSO4。
设计实验方案,完成下述表格。 限选用品与试剂:稀盐酸、pH 试纸、BaCl2 溶液、蒸馏水、AgNO3 溶液
步骤1:取少量样品于烧杯中,缓慢加入足量的蒸馏水,充分搅拌,静置,过滤。 | |
步骤2:取少量步骤1形成的溶液于试管中,向其中加入足量稀盐酸,振荡 | ________________ |
步骤3:______________ | __________,说明样品中有ZnSO4。 __________,说明样品中没有ZnSO4。 |
【答案】二氧化硫能与水反应生成酸 ①②③④ 二氧化硫不能使干燥的石蕊试纸变蓝 水不能使蓝色石蕊试纸变色,二氧化硫与水生成酸性物质 SO2+H2O=H2SO3 吸收多余的二氧化硫气体,防止污染空气 成立 CO32- 有气泡产生,说明样品中一定有碳酸钠 取少量步骤2中的溶液与试管中,加入适量的氯化钡溶液,震荡 若有白色沉淀产生 若没有白色沉淀产生
【解析】
(一)(1)二氧化碳与水反应生成碳酸,因此可以提出假设二氧化硫能(或不能)与水反应生成酸;
(3)要探究二氧化硫与水在通常情况下能发生化学反应生成酸,可以通过反应后的产物能使指示剂石蕊变红来确定,此时需要知道二氧化硫本身不显酸性,能溶于水,能被何种物质干燥而本身不发生变化,二氧化硫是否有毒,是否需要进行尾气处理;所以选①②③④;
(4)①C装置内盛有的是干燥的蓝色石蕊试纸,通过B装置干燥后的二氧化硫气体与之接触,颜色未发生变化,说明不能使干燥的蓝色石蕊试纸变红色;
②装置D中胶头滴管中的蒸馏水在气体生成之前滴到蓝色石蕊试纸上,此时只是水与石蕊试纸接触,未见试纸颜色发生变化,说明水不能使蓝色石蕊试纸变色,当有气体通过时,发现湿润的蓝色石蕊试纸变红,此时石蕊试纸既与水接触又与二氧化硫接触,说明二氧化硫与水接触得到了显酸性的物质,二氧化硫和水发生了反应:SO2+H2O=H2SO3,生成了某种酸性物质;
③根据题干叙述可以知道,二氧化硫是一种有刺激性气味的有毒气体,它能与氢氧化钠溶液反应生成盐与水,所以装置E的作用是吸收多余气体,避免污染空气(进行尾气处理);
(5)通过以上分析可以看出,二氧化硫能与水反应生成酸,所以假设成立(或不成立)或不成;
(二)(1)混合物A中有碳酸钠(Na2CO3),加水溶解、过滤后,滤液中的阴离子有:Cl- OH- CO32-;
(2)要验证硫酸锌的存在即验证硫酸根存在,首先要排除碳酸根的干扰,取少量步骤形成的溶液于试管中,加入足量的稀盐酸;碳酸钠和盐酸反应生成二氧化碳,有气泡产生;样品中一定有碳酸钠,步骤2中的溶液已经除去了碳酸根,向步骤2溶液中滴加少量氯化钡溶液;氯化钡会和硫酸锌反应生成硫酸钡沉淀:ZnSO4+BaCl2=ZnCl2+BaSO4↓,若有白色沉淀产生,说明有硫酸锌;若没有白色沉淀产生,说明没有硫酸锌。