题目内容
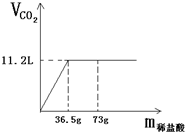
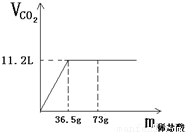
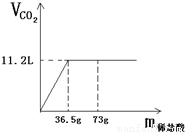
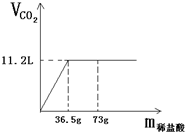
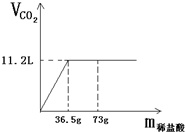 现有80g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的体积与加入的稀盐酸的质量关系如下图所示.试回答:
现有80g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的体积与加入的稀盐酸的质量关系如下图所示.试回答:(1)该石灰石样品最多可以制取CO2
22
22
g;(结果取整数,CO2的密度为1.98g/L)(2)该石灰石样品中碳酸钙的质量分数是多少?
分析:(1)根据图象中二氧化碳的体积可求出二氧化碳的质量.质量=密度×体积
(2)根据二氧化碳的质量可求出碳酸钙的质量,最后根据
×100%可求出石灰石样品中碳酸钙的质量分数.
(2)根据二氧化碳的质量可求出碳酸钙的质量,最后根据
| 碳酸钙的质量 |
| 石灰石的质量 |
解答:解:(1)二氧化碳的质量=1.98g/L×11.2L=22g
(2)设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 22g
=
x=50g
该石灰石样品中碳酸钙的质量分数=
×100%=62.5%
答:(1)二氧化碳的质量为22g,(2)石灰石样品中碳酸钙的质量分数为62.5%
故答案为:(1)22(2)62.5%
(2)设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 22g
| 100 |
| x |
| 44 |
| 22g |
x=50g
该石灰石样品中碳酸钙的质量分数=
| 50g |
| 80g |
答:(1)二氧化碳的质量为22g,(2)石灰石样品中碳酸钙的质量分数为62.5%
故答案为:(1)22(2)62.5%
点评:求反应后所得溶液的质量的计算是初中化学计算的一个重点内容,其方法一般是:所加入的所有物质的质量总和-生成气体的质量-生成沉淀的质量.

练习册系列答案
相关题目
 现有80g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的体积与加入的稀盐酸的质量关系如下图所示.试回答:
现有80g石灰石样品与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的体积与加入的稀盐酸的质量关系如下图所示.试回答: