题目内容
【题目】对比、归纳是化学学习的重要方法,请补充完成下列实验报告。
【实验目的】探究物理变化和化学变化
【实验过程】
实验操作 | 实验现象、分析或结论 | |
实验一 | 步骤一:取少量硫酸铜晶体放在研钵内观察。 | 现象:晶体为蓝色 |
步骤二:用研杵将硫酸铜晶体研碎 | 现象:___________________。 | |
步骤三:在2支试管中分别放入少量研碎前、后的硫酸铜晶体,并进入少量水,振荡得到澄清的硫酸铜溶液 | 现象:研碎后的硫酸铜晶体溶解的更快。 分析:原因是_______________________。 | |
步骤四:向上述两支试管中各滴加少量氢氧化钠溶液 | 现象:2支试管中均有蓝色不溶物生成。 分析: (1)该反应的化学方程式是_________; (2)该对比实验得出的实验结论是_______。 | |
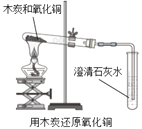
实验二 |
| 现象:有部分黑色粉末变红,澄清石灰水变浑浊。 分析: (1)粉末由黑色变成红色的过程中发生化学反应的化学方程式是___________; (2)上述现象说明木炭和氧化铜发生了化学变化。 |
【实验结论】有他物质生成的变化叫化学变化,没有其他物质生成的变化叫物理变化。
【答案】 蓝色块状晶体变为粉末状 粉末状的硫酸铜晶体与水的接触面积更大 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 物理变化前后物质的化学性质不发生改变 C+2CuO![]() 2Cu+CO2↑
2Cu+CO2↑
【解析】实验一步骤二现象根据块状硫酸铜晶体变成粉末状解答;步骤三分析根据接触面积不同解答;步骤四分析(1)根据氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜解答;(2)根据2支试管中均有蓝色不溶物生成,说明物理变化前后物质的化学性质不发生改变解答;实验二分析(1)根据碳还原氧化铜解答。实验一步骤二:用研杵将硫酸铜晶体研碎,产生的现象是:蓝色块状晶体变为粉末状;步骤三:研碎后的硫酸铜晶体溶解的更快的原因是粉末状的硫酸铜晶体与水的接触面积更大;步骤四(1)向硫酸铜溶液中滴加氢氧化钠溶液,该反应的化学方程式是2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;(2) 该对比实验得出的实验结论是物理变化前后物质的化学性质不发生改变;实验二分析(1)碳在高温的条件下将氧化铜还原成铜,同时生成二氧化碳,反应的化学方程式是C+2CuO![]() 2Cu+CO2↑。
2Cu+CO2↑。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】活性炭可处理大气污染物NO。在一定条件下的密闭容器中,NO气体与活性炭中的C反应生成甲、乙两种气体,其中甲是空气中含量最多的气体。测得各物质的质量如下表所示:
物质质量 /g 反应时间/min | 活性炭 | NO | 甲 | 乙 |
0 | 28.72 | 5.00 | 0 | 0 |
4 | 28.00 | 1.40 | x | 2.64 |
下列说法正确的是( )
A. 生成甲、乙的分子数之比为1:1
B. 反应消耗的C与NO的质量之比为2:5
C. x的值为26.76
D. 反应中活性炭只起吸附作用