题目内容
【题目】电镀是金属防锈的方法之一.某电镀厂有三个分别给金属表面镀锌、镀铜、镀银的车间,每个车间电镀液的溶质中只含有易溶的锌盐、铜盐和银盐中的一种物质.现取三个车间的电镀液于烧杯中,标为1、2、3号,某小组同学通过实验对三种电镀液中溶质成分进行探究.
[提出问题]三种电镀液中溶质的成分是什么?
[探究实验1]
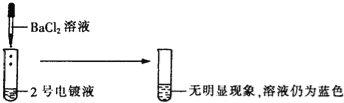
[表达与交流]甲同学认为2号电镀液中的溶质一定不是硫酸铜,你认为他的结论(1) (填“正确”或“不正确”).
[探究实验2]

[反思与评价]乙同学认为3号电镀液中的溶质一定是硫酸锌,请你对乙同学的结论给予评价(2) .
[探究实验3]根据上述实验,丙同学取少量的1号电镀液与少量的2号电镀液混合,立即出现有(3) 生成的明显现象,由此小组同学确定了三种电镀液中分别含有的溶质的成分.
解释与结论:探究实验3中发生反应的化学方程式为(4) ,请帮助他们将三种电镀液中溶质成分的化学式填写在烧杯的标签上(5).
【答案】(1)正确;(2)不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)白色沉淀;(4)CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2;(5)
【解析】
(1)2号电镀液中的溶质如果是硫酸铜,则硫酸铜和氯化钡反应会生成白色沉淀,和体重的无现象矛盾,,所以2号电镀液中的溶质一定不是硫酸铜,故答案为:正确;
(2)3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,也可能含硝酸银,因为硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,硝酸银与氯化钡反应生成氯化银是白色沉淀,故答案为:不正确;3号电镀液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸锌,硫酸锌与氯化钡反应生成硫酸钡是白色沉淀,也可能含硝酸银,硝酸银与氯化钡反应生成氯化银是白色沉淀(或产生白色沉淀只能证明3号溶液中含有硫酸根离子或银离子),因此乙同学认为3号电镀液中的溶质一定是硫酸锌是不正确的;
(3)根据题目中的实验现象,2号电镀液一定含有铜离子,3号电镀液一定含有硫酸根离子,1号电镀液是可溶的银盐,即硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,1号电镀液与少量的2号电镀液混合,会生成白色沉淀,故答案为:白色沉淀;
(4)氯化铜和硝酸银发生复分解反应,即CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2,故答案为:CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2;
(5)1号电镀液是硝酸银,则2号电镀液为氯化铜,3号电镀液为硫酸锌,故答案为: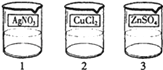 .
.

 阅读快车系列答案
阅读快车系列答案【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
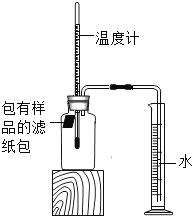
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。