题目内容
下列图象能正确反映对应变化关系的是( )
A. 稀释10%的NaOH和10%的H2SO4 |
B. 将等质量的镁片和铁片分别投入到足量等质量分数的H2SO4中 |
C.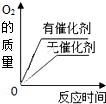 用等质量、等浓度的双氧水分别制取氧气 |
D.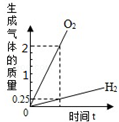 将水通电分解一段时间 |
A、向硫酸中不断加水稀释,酸性减弱,pH不断增大,向碱中不断加水稀释,碱性减弱,pH不断减小,故A错误;
B、根据金属活动性顺序,由于二者的活动性强弱不同,导致反应的时间不同.镁的活动性比铁大,故镁所需时间短,体现在图中是镁的斜率大,铁的斜率小;镁的活动性比铁强,单位时间内产生氢气的质量比铁多,而该选项中的图象是单位时间内铁产生的氢气比镁多;
假设金属的质量是24g,
Mg+H2SO4=MgSO4+H2↑
24 2
24g 2g
Fe+H2SO4=FeSO4++H2↑
56 2
24g 0.9g
可以看出相同质量的镁和铁与足量的稀硫酸反应时镁生成的氢气质量大于铁生成的氢气的质量,故B错误;
C、催化剂只改变化学反应的速率,不改变生成产物的质量,用等质量、等浓度的双氧水分别制取氧气则生成氧气的质量相同,故C错误;
D、根据水分解的化学方程式
2H2O
| ||
4 32
故生成氢气和氧气的质量比为:4:32=1:8,图象中氢气和氧气的质量比为:0.25g:2g=1:8,故D正确;
答案:D.

练习册系列答案
相关题目