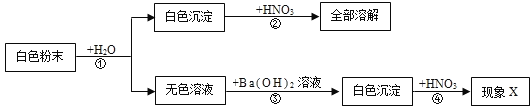
题目内容
【题目】已知氢氧化锂(LiOH)是航天员舱外服用的一种成分,这种物质和氢氧化钠有相似的化学性质。请你写出LiOH与指定类别物质反应的方程式。
(1)非金属氧化物:_______
(2)酸:________
(3)盐:________
【答案】![]() (合理即可)
(合理即可) ![]() (合理即可)
(合理即可) ![]() (合理即可)
(合理即可)
【解析】
(1)依照氢氧化钠与二氧化碳反应生成碳酸钠和水的反应可以推出氢氧化锂与二氧化碳反应生成碳酸锂和水,反应方程式为![]() ;
;
(2)依照氢氧化钠与盐酸反应生成氯化钠和水的反应可以推出氢氧化锂与盐酸反应生成氯化锂和水,反应方程式为![]() ;
;
(3)依照硫酸铜与氢氧化钠反应生成氢氧化铜和硫酸钠的反应可以推出硫酸铜与氢氧化锂反应生成氢氧化铜和硫酸锂,化学方程式为![]() 。
。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种。同学们对该粉末进行了定性与定量研究。
(定性实验)
实验方案 | 实验现象 | 实验结论 |
取少量红色粉末放入试管中,滴加足量的稀盐酸振荡 | 红色粉末全部消失,溶液呈黄色 | 粉末为Fe2O3 |
______ | 粉末Cu | |
______ | 粉末为Fe2O3和Cu混合物 |
(定量实验)
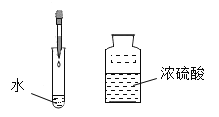
(1)取该粉末4g放入硬质玻璃管中,先通CO,然后再用酒精喷灯加热一段时间,停止加热继续通入CO至装置冷却。实验装置如图:
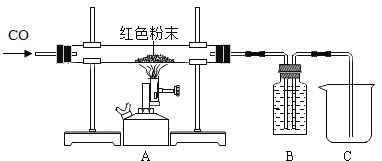
①实验时,先通CO再加热的目的是______。
②若该粉末全部是氧化铁,在硬质玻璃管中观察到的实验现象是_________,反应的化学方程式为________,该实验中B装置的作用是_________,其中盛放的试剂最好是________。
A NaOH溶液 B 稀盐酸 C 水
③若该粉末为铜粉和氧化铁的混合物,待装置完全冷却至室温,称量硬质玻璃管内剩余固体的质量为mg。则m的取值范围是________。
(2)若该粉末为铜粉和氧化铁的混合物,为了准确测定铜粉和氧化铁的混合物中氧化铁的质量分数,取10g样品于烧杯中,逐滴加入150g稀盐酸固体刚好不再溶解,过滤洗涤、恒温干、称量,剩余固体质量为2g,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O。
求:①混合物中氧化铁的质量分数______;②所用稀盐酸的质量分数______。