��Ŀ����
��5�֣�����һ����ɫ��ĩ��������NaCl��Na2SO4��Na2CO3��CuSO4�е�һ�ֻ�����ɡ���������ʵ�飺��1��ȡ������ĩ����ˮ�ܽ����ɫ��Һ����2����ȡ������ĩ���μ�ϡ���ᣬ������������ش�
����ʵ�飨1����ȷ��ԭ��ĩ��һ��û�� �� ��ʵ�飨2����ȷ��ԭ��ĩ��һ��û�� ����Ϊ��һ��ȷ��ԭ��ĩ����ɣ���ȡ������ĩ����ͼ��ʾ����ʵ�飺��ÿ�������Լ�����ͬ��
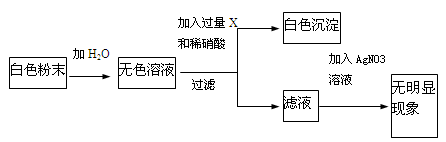
ԭ��ĩ�ijɷ��� ��д����ɫ��Һ��X��Ӧ���ɰ�ɫ�����Ļ�ѧ����ʽ ��
����ʵ�飨1����ȷ��ԭ��ĩ��һ��û�� �� ��ʵ�飨2����ȷ��ԭ��ĩ��һ��û�� ����Ϊ��һ��ȷ��ԭ��ĩ����ɣ���ȡ������ĩ����ͼ��ʾ����ʵ�飺��ÿ�������Լ�����ͬ��

ԭ��ĩ�ijɷ��� ��д����ɫ��Һ��X��Ӧ���ɰ�ɫ�����Ļ�ѧ����ʽ ��
CuSO4 �� Na2CO3�� Na2SO4 ��Na2SO4+Ba(NO3)2 ====BaSO4��+2NaNO3
�����������1��ȡ������ĩ����ˮ�ܽ����ɫ��Һ��˵����ɫ��ĩ��һ������������ͭ����Ϊ��˰��Һ������ɫ����2����ȡ������ĩ���μ�ϡ���ᣬ����������˵����ɫ��ĩ��һ��������̼���ƣ���Ϊ�������ᷴӦ������ð�����ʢ���ʵ�飨1����ȷ��ԭ��ĩ��һ��û������ͭ�� ��ʵ�飨2����ȷ��ԭ��ĩ��һ��û��̼���ƣ���Ϊ��һ��ȷ��ԭ��ĩ����ɣ���ȡ������ĩ����ʵ�飬�������Լ�X����������ɫ��������ɫ����Ϊ���ᱵ����Ϊ��Һ�м������������������ӣ���ԭ��ĩ�ijɷ��������ƣ���ɫ��Һ��X��Ӧ���ɰ�ɫ�����Ļ�ѧ����ʽNa2SO4+Ba(NO3)2 ====BaSO4��+2NaNO3

��ϰ��ϵ�д�
�����Ŀ
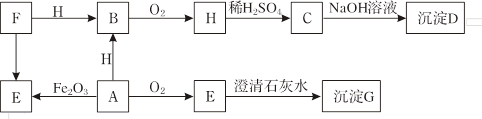
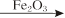 E�Ļ�ѧ����ʽ�� ����
E�Ļ�ѧ����ʽ�� ����