题目内容
【题目】金属具有广泛的应用。
(1)铁锅用来炒菜,主要是利用铁的_____性(填“导热”或“导电”)。
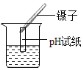
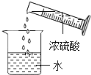
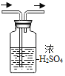
(2)下图为洁净铁钉的有关实验。
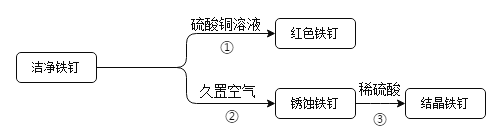
①中铁与硫酸铜反应的化学方程式为_____。
②中铁钉锈蚀主要是铁与空气中的氧气和_____发生化学反,
③中铁锈与稀硫酸反应的化学方程式为_____。
(3)某炼铁厂要冶炼![]() 含杂质
含杂质![]() 的生铁,需要含
的生铁,需要含![]() 赤铁矿石的质量是_____t(计算结果精确至0.1)。
赤铁矿石的质量是_____t(计算结果精确至0.1)。
(4)某金属粉末可能由镁、锌、铁、铝、银中的一种或几种组成。取该样品2.4g,向其中加入100g一定溶质质量分数的稀硫酸,恰好完全反应,生成0.2g氢气,得到无色溶液,固体无剩余。下列说法正确的是_____(填序号)。
A 样品中一定含有镁
B 样品中一定不含有银,可能含有铁
C 所得溶液中溶质总质量为12g
D 加入的稀硫酸的溶质质量分数为19.6%
【答案】导热 ![]() 水蒸气
水蒸气 ![]() 1732.1 C
1732.1 C
【解析】
(1)铁锅用来炒菜,主要是利用铁的导热性;
(2)
①中铁与硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为![]() ;
;
②中铁钉锈蚀主要是铁与空气中的氧气和水发生复杂的化学反应,生成主要成分为氧化铁的铁锈;
③铁锈主要成分是氧化铁,氧化铁与稀硫酸反应生成硫酸铁和水,反应的化学方程式为![]() ;
;
(3)炼铁的原理是利用一氧化碳在高温条件下还原氧化铁,设需要含Fe2O380%赤铁矿石的质量为x,

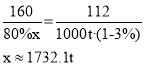
(4)
A、设2.4g纯金属镁、锌、铝和稀硫酸反应生成氢气质量分别为a、b、c,
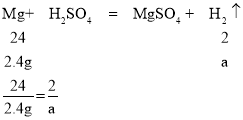
解得a=0.2g
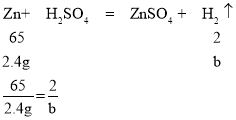
解得b≈0.07g

解得c≈0.27g,
根据生成氢气的质量关系可知金属粉末的组成可能只有金属镁一种,也可能是铝和锌两种,也可能是镁、铝、锌三种,故选项不正确;
B、根据题目“得到无色溶液,固体无剩余”可知,固体混合物中一定没有Fe(否则溶液显浅绿色),也一定没有Ag(否则有固体剩余),故选项不正确;
C、由题意可知金属和硫酸根离子全部结合生成硫酸盐,溶液中溶质硫酸盐的质量应等于金属质量和硫酸根离子的质量和,设硫酸根离子的质量为d,
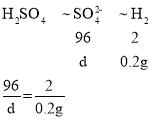
解得d=9.6g,则生成的溶质硫酸盐的质量=2.4g+9.6g=12g,故选项正确;
D、由题可知硫酸完全反应生成氢气质量为0.2g,设硫酸溶液的溶质质量分数为y,
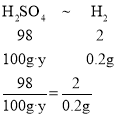
解得y=9.8%, 故选项不正确;故填C。