题目内容
【题目】某样品由氧化铜和铜组成。取10.0g该样品于烧杯中,向其中加入92.0g稀硫酸,恰好完全反应后,过滤,所得滤液质量为100.0g。
(1)所取样品中铜的质量为_____。
(2)从反应后所得的100.0g滤液中取出10.0g溶液,将其稀释为10%的溶液,需要加水多少克___________?
【答案】2.0g6g
【解析】
根据溶液质量变化确定氧化铜的质量,进而结合对应的化学方程式求算所得溶液中溶质的质量分数,然后根据稀释过程中溶质的质量不变进行求算。
(1)在金属活动顺序表中,铜排在氢之后,铜不能与硫酸反应。根据溶液质量变化可知,铜的质量=92g+10g-100.0g= 2.0g,氧化铜的质量=10.0g-2.0g=8.0g;
(2)设:反应后所得溶液中溶质的质量为x
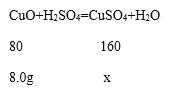
![]()
x=16.0g
反应后所得溶液中溶质的质量分数=![]() ×100%=16%;
×100%=16%;
从反应后所得的100.0g滤液中取出10.0g溶液,将其稀释为10%的溶液,需要加水=![]() ﹣10.0g=6.0g
﹣10.0g=6.0g
答:(1)所取样品中铜的质量为2.0g。
(2)从反应后所得的100.0g滤液中取出10.0g溶液,将其稀释为10%的溶液,需要加水6g。

练习册系列答案
相关题目