题目内容
(2013?金山区二模)某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙,设计实验方案如图.
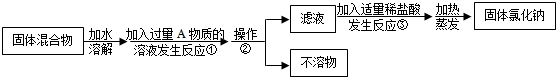
请回答下列问题:
①写出A物质的化学式
②操作②的名称是
③写出反应③的化学方程式
④反应①中加入过量A物质的目的是
⑤分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果

请回答下列问题:
①写出A物质的化学式
Na2CO3
Na2CO3
,该物质的俗称是纯碱
纯碱
,该物质的水溶液能够使紫色石蕊试液变蓝
蓝
色;②操作②的名称是
过滤
过滤
;③写出反应③的化学方程式
Na2CO3+2HCl═2NaCl+CO2↑+H2O
Na2CO3+2HCl═2NaCl+CO2↑+H2O
;④反应①中加入过量A物质的目的是
使CaCl2充分反应
使CaCl2充分反应
,反应③中如果加入盐酸也过量,则对所得到的氯化钠纯度没有
没有
(填“有”或“没有”)影响;⑤分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果
增大
增大
(填“增大”、“不变”或“减少”).分析:本题中的氯化钠和氯化钙都属于盐,属于除杂质题,除杂质题最少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.要除去氯化钠中的少量杂质氯化钙,只要除去钙离子就可以了,氯离子不是杂质.因此可以加入足量是碳酸钠溶液(俗名纯碱或苏打),生成白色沉淀碳酸钙,从而除去钙离子,得到的沉淀和溶液可以用过滤的方法分开.过量的碳酸钠可以用稀盐酸除去,在每个步骤中都有氯化钠生成,因此氯化钠的质量是增加的.
解答:解:①、要除去氯化钠中的少量杂质氯化钙,只要除去钙离子就可以了,氯离子不是杂质.因此可以加入足量的碳酸钠溶液,生成白色沉淀碳酸钙,从而除去钙离子.故A是碳酸钠的俗名是纯碱或苏打.Na2CO3的溶液呈碱性能使紫色的石蕊试液变蓝.
②、操作②是分离固体和液体的操作,所以该操作是过滤;
③、②的化学方程式是指过量的碳酸钠与稀盐酸的反应,它们互相交换成分生成氯化钠和水和二氧化碳,要注意配平.方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
④、反应①中加入过量A物质的目的是使氯化钙充分反应;反应②中如果加入盐酸也过量,对所得的氯化钠的纯度无影响,因为盐酸具有挥发性并且是液体.加热氯化氢会挥发且不会有残留.
⑤、分离后所得氯化钠的质量与原来氯化钠的质量相比较增多了,原因是每一步除杂质的过程中都生成了氯化钠.
故答案为:①Na2CO3;纯碱;蓝;②过滤;③Na2CO3+2HCl═2NaCl+CO2↑+H2O;④使CaCl2充分反应;没有;增大.
②、操作②是分离固体和液体的操作,所以该操作是过滤;
③、②的化学方程式是指过量的碳酸钠与稀盐酸的反应,它们互相交换成分生成氯化钠和水和二氧化碳,要注意配平.方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
④、反应①中加入过量A物质的目的是使氯化钙充分反应;反应②中如果加入盐酸也过量,对所得的氯化钠的纯度无影响,因为盐酸具有挥发性并且是液体.加热氯化氢会挥发且不会有残留.
⑤、分离后所得氯化钠的质量与原来氯化钠的质量相比较增多了,原因是每一步除杂质的过程中都生成了氯化钠.
故答案为:①Na2CO3;纯碱;蓝;②过滤;③Na2CO3+2HCl═2NaCl+CO2↑+H2O;④使CaCl2充分反应;没有;增大.
点评:本考点属于物质的分离和提纯,是中考的重点也是一个难点,本题利用图式设计出相应的实验步骤,分步骤进行分离,同学们只要认真分析,根据条件综合把握,问题就会迎刃而解.本考点经常出现在选择题、填空题和实验题中.

练习册系列答案
相关题目