题目内容
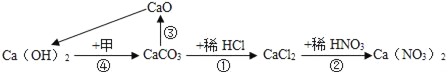
【题目】工业上生产镀铜电路板及处理废液的工艺流程如下:

(1)由步骤①可判断FeCl3与铜反应生成的两种产物是FeCl2和___。
(2)步骤②加入过量的铁粉,除能与废液中FeCl3反应外,还可发生反应的化学方程式为__,滤渣是___和___。
(3)步骤③加入稀盐酸,充分搅拌,当观察到___现象时,说明滤渣只剩铜。
【答案】CuCl2 Fe+CuCl2═FeCl2+Cu 铁 铜 不再有气泡产生
【解析】
(1)向镀铜的电路板中加入氯化铁溶液后生成了氯化铜和氯化亚铁,故填:CuCl2;
(2)铁的活动性比铜强,所以可以将铜从它的化合物的溶液中置换出来,化学方程式为Fe+CuCl2═FeCl2+Cu;得到的滤渣是生成的铜和剩余铁,故填:Fe+CuCl2═FeCl2+Cu;铁;铜;
(3)加入过量的铁粉过滤后的得到滤渣应该为铁粉和铜的混合物,所以加入盐酸后,铁要和盐酸反应产生氢气,而铜不反应,所以至不在产生气泡时得到的固体只有铜单质;故填:不再有气泡产生。

练习册系列答案
相关题目
【题目】在一密闭容器内有氧气、氮气、水蒸气和一种初中课本中出现的气体物质W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法中错误的是( )
物质 | W | 氧气 | 氮气 | 水蒸气 |
前质量/g | 68 | 100 | 2 | 2 |
反应后质量/g | X | 4 | 58 | 110 |
A. X的值应为0
B. 反应前后氮元素的化合价发生了变化
C. 物质W中不含氧元素
D. W与氧气的相对分子质量之比为17:24