题目内容
【题目】我市莱州湾盐场盛产食盐。请回答下列问题。
(1)如图1,请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
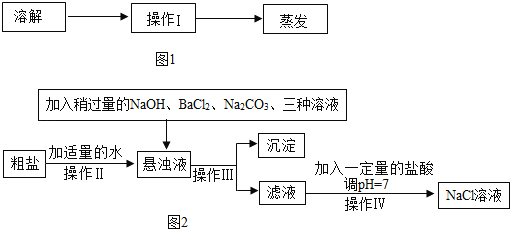
①操作Ⅰ所用的玻璃仪器有:_____。
②在蒸发过程中,待_____时,停止加热。该过程中玻璃棒的作用是_____。
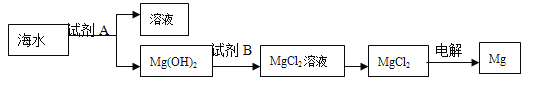
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如图2。
①加入稍过量的Na2CO3溶液除了能除去粗盐中_____的外,它还有一个作用是_____(用化学方程式表示)。
②操作Ⅳ加入一定量盐酸的作用是除去_____(写离子符号)。
③假设除杂过程中氯化钠没有损失,则理论上除杂后获得食盐的质量_____除杂前食盐的质量(填“>““<“或“=”),其理由是_____。
(3)食盐是人体进行正常新陈代谢的必需品,在生活中可以做_____(写一点即可)。
【答案】漏斗、玻璃棒和烧杯 出现较多固体 搅拌,防止液体局部过热而溅出 CaCl2 Na2CO3+BaCl2=BaCO3↓+2NaCl CO32﹣、OH﹣ > 除杂过程中又生成氯化钠 调味品
【解析】
(1)去除粗盐中泥沙的步骤是:溶解、过滤和蒸发结晶,所以:
①操作Ⅰ是过滤,所用的玻璃仪器有:漏斗、玻璃棒和烧杯;故填:漏斗、玻璃棒和烧杯
②在蒸发过程中,待蒸发皿中出现较多固体时,停止加热,该过程中玻璃棒的作用是搅拌,防止液体局部过热而溅出;故填:出现较多固体;搅拌,防止液体局部过热而溅出;
(2)①碳酸钠可以除去反应中过量的氯化钡和氯化钙,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;故填:CaCl2;Na2CO3+BaCl2=BaCO3↓+2NaCl;
②操作Ⅳ加入一定量盐酸的作用是除去氢氧化钠和碳酸钠;故填:CO32﹣、OH﹣;故填:CO32﹣、OH﹣
③假设除杂过程中氯化钠没有损失,则理论上除杂后获得食盐的质量大于除杂前食盐的质量,其理由是除杂过程中又生成氯化钠;故填:>;除杂过程中又生成氯化钠
(3)食盐具有咸味,所以在生活中可以做调味品。故填:调味品