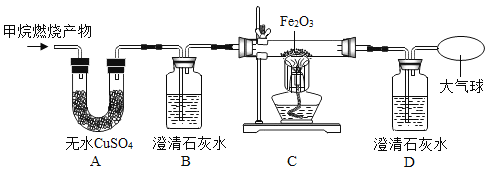
题目内容
【题目】生活中常见的铁制品大多为铁合金(成分为铁和碳)材料,而非纯铁,铁合金又因其含碳量不同分为生铁和钢(生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%)。将一块质量为5.8g的铁合金放入烧杯中,再向烧杯中加入98g稀硫酸,恰好与铁合金中的铁完全反应,反应后则得总质量比反应前减少0.2g。通过计算回答该铁合金是生铁还是钢__________________? ( 写出计算过程,结果精确到0.1%)
【答案】该铁合金是生铁(计算过程见解析)
【解析】
由题意,铁与稀硫酸反应生成氢气的质量为0.2g,设参加反应的铁的质量为x,则有

由![]()
解得x=5.6g
该铁合金中的含碳量为![]()
2%<3. 4%<4. 3%,故该铁合金是生铁。
答:该铁合金是生铁。

 阅读快车系列答案
阅读快车系列答案【题目】在一个密闭容器中放入X、Y、Z、W在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识错误的是( )
物质 | X | Y | Z | W |
反应前的质量/g | 20 | 5 | 2 | 37 |
反应后的质量/g | 待测 | 35 | 2 | 12 |
A.物质Z可能是该反应的催化剂
B.待测物质的值为15
C.该反应是分解反应
D.反应中X、W的质量比为1: 5
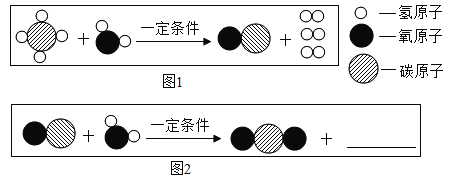
【题目】X 是合成维生素A的重要原料.工业上用物质甲和乙在一定条件下反应生成物质丙和X,甲、乙和丙的微观示意图见下表.
物质 | 甲 | 乙 | 丙 | X | |
微观示意图 |
|
|
| ? |
|
该反应中甲、乙、丙的质量比为 23:17:1.下列判断不正确的是( )
A.X 属于化合物B.该反应方程式中乙与丙的化学计量数之比为 2:3
C.物质X 中含三种元素D.该反应为置换反应
【题目】在一个密闭容器中放入W、G、H、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表:
物质 | W | G | H | P |
反应前质量/g | 18 | 1 | 2 | 32 |
反应后质量/g | 待测 | 26 | 2 | 12 |
对该反应的认识正确的是![]()
![]()
A. W待测值是13
B. 该反应是分解反应
C. P是生成物
D. 物质H是该反应的催化剂