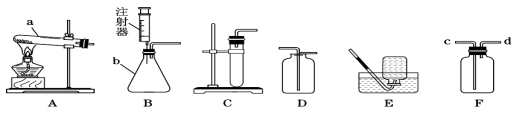
题目内容
【题目】在今年的化学活动周中,某校兴趣小组同学在《培养中学生基本科学素养的化学实验教学研究》课题组老师的指导下,将课本“测定空气中氧气的含量”实验装置(如甲图)改进为新的实验装置(如乙图),改进后的实验装置相对于原装置,以下评价不恰当的是
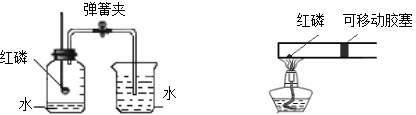
甲 乙
A.反应容器体积小,药品消耗少
B.装置简洁,减少了甲图装置中导管引起的误差
C.红磷的量多少对实验的结果无影响
D.容器内径相等,易准确推算出空气中氧气的含量
【答案】C
【解析】
试题分析:从图示看:反应容器体积小,药品消耗少;装置简洁,减少了甲图装置中导管引起的误差;红磷的量多少对实验的结果有影响,如果红磷不足会导致氧气剩余,影响实验数据;容器内径相等,易准确推算出空气中氧气的含量。故选C.

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 (“同意”或“不同意”)小明的观点,因为 。
(3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
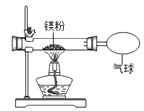
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
实验操作 | 实验现象及结论[ |
(4)为了证明镁可在氮气中燃烧生成氮化镁,小红又设计了如下方案进行验证。
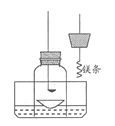
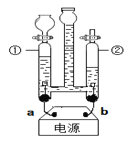
步骤①:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置;另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条。
步骤②:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的 左右。
步骤③:往水槽中加水使广口瓶内外水面相平;点燃镁条,迅速更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量;待冷却后广口瓶内水位继续上升。
A.步骤②的目的是 。写出红磷在氧气中燃烧的化学方程式
B.在步骤③“待冷却后广口瓶内水位继续上升”是由于瓶内气压 (选填“大于” “小于”或“等于”)外界气压
C.写出镁在氮气中燃烧生成氮化镁的化学方程式
【反思与交流】
(5)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却大于Mg3N2。请给出合理的解释 。