题目内容
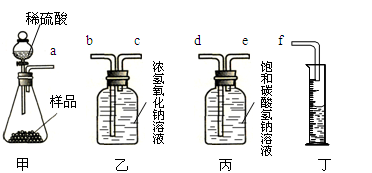
某化工厂生产的纯碱中含有少量的氯化钠。化学活动小组的同学合理利用下列装置对此样品进行分析。根据进入量筒中液体的体积来计算该样品中纯碱的含量。已知二氧化碳在饱和碳酸氢钠溶液中溶解度极小。
请你与活动小组的同学一起思考并回答下列问题:
(1)进行实验时,应选择上述装置中的 组合更合理(选填甲、乙、丙、丁)。所选装置各导管的连接顺序从左到右依次为 (填导管序号)。
(2)反应开始后,甲中有气泡产生,该反应的化学方程式为 。
(3)若甲中采用盐酸进行实验,测得数据与用稀硫酸时不一致,则采用稀盐酸时测得样品中纯碱的质量分数 (填较大、较小)。
(4)实验中,若样品取量过多,可能导致反应液体外溢,造成实验误差;若样品取量太少,会导致 ,也会造成实验误差。

请你与活动小组的同学一起思考并回答下列问题:
(1)进行实验时,应选择上述装置中的 组合更合理(选填甲、乙、丙、丁)。所选装置各导管的连接顺序从左到右依次为 (填导管序号)。
(2)反应开始后,甲中有气泡产生,该反应的化学方程式为 。
(3)若甲中采用盐酸进行实验,测得数据与用稀硫酸时不一致,则采用稀盐酸时测得样品中纯碱的质量分数 (填较大、较小)。
(4)实验中,若样品取量过多,可能导致反应液体外溢,造成实验误差;若样品取量太少,会导致 ,也会造成实验误差。
(1)甲、丙、丁 a e d f
(2)Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
(3)较大
(4)生成的气体过少,气体压强太小,液体不能压入量筒中
(2)Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
(3)较大
(4)生成的气体过少,气体压强太小,液体不能压入量筒中
本题考查的是碳酸钠、碳酸氢钠与碳酸钙,实验数据处理或者误差分析的探究,测量容器-量筒,酸的化学性质,化学实验方案设计与评价。
(1)根据题意,稀硫酸与样品中的碳酸钠反应生成的CO2能和浓氢氧化钠溶液反应,而被其吸收,也就无法排除液体以测量体积;而二氧化碳在饱和碳酸氢钠溶液中溶解度极小,二氧化碳能将碳酸氢钠溶液排到量筒中,量筒中液体的体积等于生成的二氧化碳的体积,故选甲、丙、丁。由于气体密度小于液体,要排出洗气瓶中的液体,则气体应由短管进入,故接口顺序为a、e、d、f。
(2)碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,故反应的化学方程式为Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑。
(3)盐酸具有挥发性,挥发出的氯化氢会与碳酸氢钠反应生成二氧化碳,使测量结果偏大。
(4)若样品取量太少,则反应生成的气体量过少,气体压强就小,液体就不能被压入量筒中,也就无法测量。
(1)根据题意,稀硫酸与样品中的碳酸钠反应生成的CO2能和浓氢氧化钠溶液反应,而被其吸收,也就无法排除液体以测量体积;而二氧化碳在饱和碳酸氢钠溶液中溶解度极小,二氧化碳能将碳酸氢钠溶液排到量筒中,量筒中液体的体积等于生成的二氧化碳的体积,故选甲、丙、丁。由于气体密度小于液体,要排出洗气瓶中的液体,则气体应由短管进入,故接口顺序为a、e、d、f。
(2)碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,故反应的化学方程式为Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑。
(3)盐酸具有挥发性,挥发出的氯化氢会与碳酸氢钠反应生成二氧化碳,使测量结果偏大。
(4)若样品取量太少,则反应生成的气体量过少,气体压强就小,液体就不能被压入量筒中,也就无法测量。

练习册系列答案
相关题目
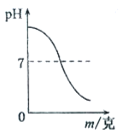
 pH
pH