题目内容
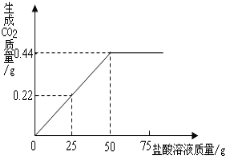
【题目】现有含HCl和CuCl2的混合溶液50g,向该溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的质量关系如下图所示。

① 写出有关的反应方程式 ⒂ , ⒃ ;
② 当加入NaOH溶液质量为ag时,溶液中的溶质是 ⒄ ;
③ 求混合溶液中CuCl2的质量分数 ⒅ 。
(请根据化学方程式计算)
④ 求恰好完全反应时,消耗NaOH溶液的总质量 ⒆ 。
【答案】①NaOH+ HCl → NaCl +H2O ; 2NaOH + CuCl2 → 2NaCl +Cu(OH)2↓②NaOH、NaCl③27%;④120g
【解析】
试题分析:①根据题的叙述可知反应方程式为NaOH+ HCl → NaCl +H2O ; 2NaOH + CuCl2 → 2NaCl +Cu(OH)2↓
②根据图像中可知a点为酸碱中和反应和碱、盐反应结束后故溶液中的溶质为剩余的NaOH、生成的NaCl
③设混合溶液中含CuCl2 Xmol ,与CuCl2 反应的NaOH为Ymol
2NaOH + CuCl2 → 2NaCl +Cu(OH)2↓
2mol 1mol 1mol
Ymol Xmol 0.1mol
X=0.1mol ………………………(1分)
CuCl2的质量=0.1 mol×135g/ mol =13.5g
CuCl2%=13.5 g /50 g*100% =27% ………………………(1分)
④ Y=0.2 mol
NaOH溶液的质量=0.2 mol*40g/mol/10%=80g
NaOH溶液的总质量为80+40=120 g

练习册系列答案
相关题目