题目内容
【题目】(10分)化学是一门研究物质的科学,我们一般从物质的存在、性质、制备、用途等方面研究一种物质或一类物质。以金属为例,请你参与其中回答相关问题:
(1)认识金属元素存在:自然界中大多数金属都以化合物的形式存在。
下列矿石的主要成分属于氧化物的是_ (填字母序号,下同);
A.铝土矿 (主要成分A12O3)
B.钾长石(主要成分KAlSi3O8)
C.赤铁矿 (主要成分Fe2O3)
D.磁铁矿 (主要成分Fe3O4)
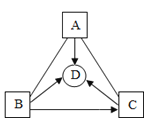
(2)探究金属性质:金属原子容易失去最外层电子,化学性质活泼。图1为探究金属化学 性质的实验,图2是金属化学性质网络图。
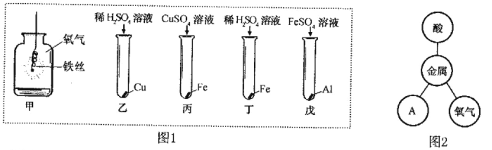
①图1甲中反应现象是__ 丙中反应的化学方程式为_ ;
②图1只有乙中不反应,能得出三种金属活动性及它们和氢元素的位置关系,由强到弱的顺序是 _ (填元素符号);
③依据图1完成金属性质网络,图2中的A属于_ (填物质类别);
(3)认识金属的制备:工业上常采用还原法、置换法、电解法制备金属。
用一氧化碳还原赤铁矿冶铁反应的化学方程式为_
(4)金属在生产生活中应用广泛。
①下列金属制品的用途,利用其导电性的是_
A.铁锅 B.铜导线 C.铝箔 D.黄金饰品
②合金性能优于单一金属,因而被广泛应用。焊锡(主要含锡、铅)与其组成金属相比
具有_ 的特性,可用于焊接电子元件;
③ 金属是一种有限资源,需要保护和回收利用。
黄铜(铜锌合金)用作弹壳的制造。现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示。
【收集资料】弹壳上的锈主要为Cu2( OH)2C03,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应。
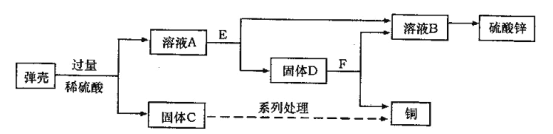
a.写出弹壳上的锈与稀硫酸反应的化学方程式 。
b.固体D为_ 。
【答案】(1)ACD
(2)①剧烈燃烧,火星四射,生成黑色固体。 Fe+CuSO4==FeSO4+Cu。
②铝、铁、(氢)、铜;③盐;
(3)3CO+Fe2O3 2Fe+3CO2
(4)①B;②熔点较低
③a、Cu(OH)2 CO3+2H2SO4== 2CuSO4+3H2O+CO2
b、锌和铜
【解析】
试题分析:(1)氧化物是由两种元素组成且其中一种元素为氧元素的化合物,所以ACD符合要求;B中主要成分是由四种元素组成,不符合要求。
(2)①甲中实验为铁丝在氧气中燃烧,实验现象为:剧烈燃烧,火星四射,生成黑色固体。丙为铁和硫酸铜反应,化学方程式为:Fe+CuSO4==FeSO4+Cu。
②戊中反应,可说明铝的活动性大于铁,丁中反应,可说明铁的活动性大于氢;丙中反应,可说明铁的活动性大于铜;乙中不反应,可说明铜的活动性小于氢;所以此实验说明三种金属的活动性由强到弱的顺序为铝、铁、(氢)、铜;
③金属还可与某些盐溶液发生置换反应;所以其类别为盐;
(3)一氧化碳有还原性,可与氧化铁反应生成铁和二氧化碳,化学方程式为:3CO+Fe2O3 2Fe+3CO2
(4)①铜导线利用铜具有良好的导电性;
②焊锡的熔点较低,在日常生活中用于焊接电子元件;
③a、弹壳上的锈为Cu(OH)2 CO3,可与硫酸反应生成硫酸铜、水和二氧化碳气体;反应的化学方程式为:Cu(OH)2 CO3+2H2SO4== 2CuSO4+3H2O+CO2
b、弹壳的成分为铜锌合金,加入稀硫酸时锌可反应生成硫酸锌;而铜不反应(固体C);溶液A的成分为:硫酸锌与硫酸铜[Cu(OH)2 CO3与硫酸反应生成]。可向其中加入过量的锌。锌与硫酸铜生成铜和硫酸锌;由于锌过量,所以固体D为锌和铜的混合物。

【题目】铁生锈探秘
为探究铁生锈的原因,化学兴趣小组的同学进行了如图所示的四个实验:
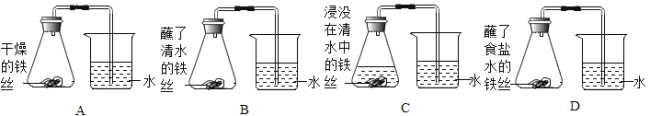
实验结果显示:B、D实验中铁生了锈,而A、C实验中没有明显的现象,仔细分析这4 个实验,回答下列问题:
(1)评价方案
对照实验指除了一个变量外,其他的量都保持不变的实验.该实验方案中采用了对照实验方法.请指出其中的对照实验(填ABCD实验代号)和变量.
第①组对照实验 ,变量 .
第②组对照实验 ,变量 .
第③组对照实验 ,变量 .
(2)解释数据
实验时,每隔一段时间测量导管内水面上升的高度,结果如下表所示(表中所列数据为导管中水面上升的高度/cm ):
时间/小时 编号 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
A | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
B | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
C | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
D | 0 | 0.4 | 1.2 | 3.4 | 7.6 | 9.5 | 9.8 |
导致B、D实验装置中导管内水面上升的原因是 .
(3)获得结论
根据本实验,你认为导致铁生锈的物质有 ;能加快铁生锈的物质是 .
【题目】下列除去杂质的方法中正确的是
选项 | 物质 | 杂质 | 除杂质的方法 |
A | CaCl2溶液 | 稀盐酸 | 加过量碳酸钙,过滤 |
B | K2CO3溶液 | KCl | 加适量稀盐酸 |
C | CaO | CaCO3 | 加水,过滤 |
D | NaCl溶液 | Na2CO3 | 加适量硝酸钙溶液,过滤 |