题目内容
【题目】下图是实验室制取某些常见气体所使用的一些装置和仪器。
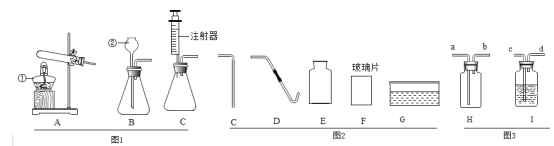
(1)写出图中标号仪器的名称:②___________。
(2) 实验室用A装置制取氧气,反应的方程式为_________,做铁丝在氧气中燃烧的实验时通常选择图2中的___________(填编号)仪器进行组合来收集氧气,若用图3的H装置来收集氧气,气体应从_______(填“a”或“b”)端通入。
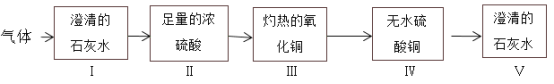
(3)实验室选择B装置来制取二氧化碳,其反应方程式为____________,图3 I可检验一氧化碳中混有少量二氧化碳气体,瓶中装石灰水,混合气体从_____(填“c”或“d”)端进入,发生的反应方程式为_________;
(4)常温下电石(CaC2)与水反应可生成乙炔(C2H2)气体和熟石灰,该反应的化学方程式可表示为______,青阳初级中学的同学们在实验时发现该反应非常剧烈,为了得到平稳的气流,他们应该选择的最佳发生装置是________。
(5)制取氧气的反应结束后,若要将试管内固体剩余物中的MnO2回收利用,需要按照以下流程进行分离:
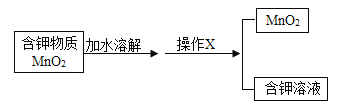
操作X的名称是___________,在实验室中进行该操作时用到的玻璃仪器有漏斗、烧杯、____________,其作用为______________。
【答案】长颈漏斗 2KMnO4![]() K2MnO4+MnO2+O2
K2MnO4+MnO2+O2![]() DEFG b CaCO3+2HCl=CaCl2+H2O+CO2
DEFG b CaCO3+2HCl=CaCl2+H2O+CO2![]() c Ca(OH)2+CO2=CaCO3
c Ca(OH)2+CO2=CaCO3![]() +H2O CaC2+2H2O=C2H2↑+Ca(OH)2 图1C 过滤 玻璃棒 引流
+H2O CaC2+2H2O=C2H2↑+Ca(OH)2 图1C 过滤 玻璃棒 引流
【解析】
(1)由图可知,仪器②为长颈漏斗,故填写:长颈漏斗;
(2)A装置的试管口有一团棉花,是高锰酸钾加热制氧气,除了生成氧气,还生成二氧化锰和锰酸钾,故填写:2KMnO4![]() K2MnO4+MnO2+O2
K2MnO4+MnO2+O2![]() ;
;
做铁丝在氧气中燃烧的实验,需要氧气的纯度大,而且为了防止铁丝的熔融物溅落瓶底,将集气瓶炸裂,集气瓶底要装水,所以,用排水集气法收集氧气,仪器组合为:DEFG,故填写:DEFG;
氧气密度略大于空气,可以采用向上排空气法收集氧气,瓶口向上时,收集气体的导管要伸入集气瓶底,故填写:b;
(3)稀盐酸与大理石反应,生成氯化钙、水和二氧化碳,故填写:CaCO3+2HCl=CaCl2+H2O+CO2![]() ;
;
因为要检验一氧化碳中混有少量二氧化碳气体,混合气体要接触石灰水,即长管进入,故填写:c;
石灰水中的氢氧化钙与二氧化碳反应生成沉淀碳酸钙和水,故填写:Ca(OH)2+CO2=CaCO3![]() +H2O;
+H2O;
(4)常温下电石(CaC2)与水反应可生成乙炔(C2H2)气体和氢氧化钙,故填写:CaC2+2H2O=C2H2↑+Ca(OH)2;
反应非常剧烈,说明反应速率太快,由图1可知,能更好的控制反应速率的装置是C,故填写:图1C;
(5)能将固液分离的操作是过滤,操作X的名称是过滤,故填写:过滤;
过滤用到的玻璃仪器是:漏斗、烧杯、玻璃棒,故填写:玻璃棒;
玻璃棒在过滤中的作用是:引流,故填写:引流。

 阅读快车系列答案
阅读快车系列答案【题目】实验课上同学们在实验室制取二氧化碳时,错拿稀硫酸倒入盛有石灰石的试管中,发现产生气泡速度越来越慢。于是同学们展开探究。
[查阅资料]石灰石与稀硫酸反应与稀盐酸反应非常相似,但是由于反应生成的硫酸钙微溶物会覆盖在石灰石的表面,阻碍了石灰石与稀硫酸的接触,反应会逐渐缓慢,因此通常不选用大理石与稀硫酸反应制取二氧化碳,请写出石灰石与稀盐酸反应的化学方程式_____。
实验活动一 选择合适浓度的硫酸
操作:室温下,用装有5ml硫酸溶液的注射器向盛有1g 直径为2mm石灰石的试管中注入不同浓度的稀硫酸,记录15分钟内生成气体的体积,观察现象,记录见表一。
表一
试管编号 | 1 | 2 | 3 | 4 | 5 |
硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
气体体积( mL) | 35 | 47 | 55 | 51 | 42 |
实验活动二 选择合适反应温度:
操作:在盛有1g直径约为2mm石灰石的试管中分别加入5ml相同合适浓度但温度不同的稀硫酸溶液,观察现象,记录见表二。
表二
试管编号 | A | B | C | D | E |
温度(℃) | 40 | 50 | 60 | 70 | 80 |
现象和比较 | 有少量气泡 | 气泡比A试管多 | 气泡明显比B试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
(1)分析处理以上表中数据,可得出的结论有:
①室温下,稀硫酸与大理石反应选用硫酸的浓度最合适为_____;
②当硫酸浓度一定时,反应速度与温度之间存在的关系是_____;其中最合适用于实验室制取二氧化碳的反应温度为_____。

(2).上述实验活动后有同学又进一步提出问题:化学反应速率还受什么因素影响?设计装置如图所示。本实验采用的方法是_____,装置中红墨水的作用是_____实验中可观察到_____,由此可得出的结论是_____。
【题目】我们知道,空气中氧气约占总体积的1/5,物质燃烧与空气中氧气密切相关。为此,小华进行了相关实验探究:
(实验探究)小华利用下列装置进行实验:

(实验操作及记录)(请你补充完整实验二)
实验 | 操作 | 现象 |
实验一 | 点燃酒精灯 | 硫燃烧,发出微弱的淡蓝色火焰 |
实验二 | 1.更换燃烧管(装有等量硫粉),挤压滴管A当观察到_____的现象时,可认为空气已经排尽 2.点燃酒精灯 | 硫没有燃烧 |
实验三 | 1.更换燃烧管(装有等量硫粉),挤压滴管B 2.当E处能使带火星的木条复燃时点燃酒精灯 | 硫燃烧很旺,发出明亮的蓝紫色火焰 |
(结果分析)
(1)对照实验一和实验_____的现象,说明硫燃烧需要氧气。
(2)对照实验三和实验一的现象,可知燃烧的剧烈程度与_____有关。
(交流与反思)小华为了进一步探究“是否只有纯氧才能使带火星的木条复燃”,又进行了以下实验:利用如图装置收集4瓶气体(集气瓶预先装满水,量筒规格为100mL),以带火星的木条进行检验。结果如下:
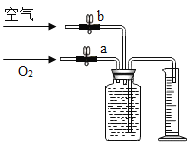
1号瓶 | 2号瓶 | 3号瓶 | 4号瓶 |
34mL O2+66mL 空气 | 35mL O2+65mL 空气 | 36mL O2+64mL 空气 | 37mL O2+63mL 空气 |
不复燃 | 不复燃,但很亮 | 很亮,复燃 | 立即复燃 |
据此可知,当O2的体积分数达到_____时(精确到1%),即可使带火星的小木条复燃。
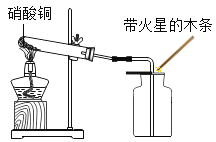
(拓展资料)提供资料:
1.相同条件下,两种气体的体积比等于分子个数比。
2.硝酸铜固体加热分解生成氧化铜、二氧化氮和氧气。小华利用如图实验加热硝酸铜,发现收集的气体能使带火星木条复燃。请你根据该反应的化学方程式分析判断NO2_____(填“有”“无”或“无法确定”)助燃性。
【题目】把A、B、C三种纯净物放在一密闭的容器中,在一定条件下充分反应,反应前后各物质的质量如下表:
物质 | A | B | C |
反应前质量/g | 10 | 2 | 6.2 |
反应后质量/g | 2 | X | 0 |
(1)上表中X的值为_____。
(2)容器中发生的反应属于_____(选填:化合或分解)反应。
(3)若A的相对分子质量为32,B的相对分子质量为142,则该反应的化学方程式中A与B的化学计量数之比为_____。