��Ŀ����
����Ŀ�������ÿ�ѧ����ʶ����ķ�ʽ��ʶ����������
��1���ӷ���Ƕȣ�������������������������
��2�����۽Ƕȣ��á� ![]() ��ʾ��ԭ�ӣ���
��ʾ��ԭ�ӣ��� ![]() ����ʾ��ԭ�ӣ� ͬ��ͬѹ�£����������ȵ��ڷ�����Ŀ�ȣ��������������ɷֺ��Բ��ƣ�ͼ�пɱ�ʾ������ģ�͵��������ţ���
����ʾ��ԭ�ӣ� ͬ��ͬѹ�£����������ȵ��ڷ�����Ŀ�ȣ��������������ɷֺ��Բ��ƣ�ͼ�пɱ�ʾ������ģ�͵��������ţ���
��3���ӱ仯�Ƕȣ� ����֪�������£������е㩁196�棬�����е㩁183�森��˹�ҵ�Ϸ���Һ̬������ȡ����ʱ�����ȴ�Һ̬����������������
���������������IJⶨ
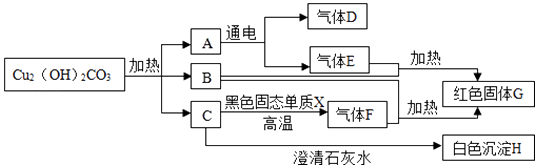
�̲��н������������ö����ķ����о��˿����ijɷ֣�ʵ��װ����ͼ1����
��ʵ����ѡ��ʹ�ù����ŵ��� ��
A���ܽ��ܱ�װ���ڿ����е����������ľ�
B���ڹ�������Һ�������
C�����ɵĻ�������ȷֽ����ܵõ���������
D��ʵ�������û����Ⱦ
ij��ȤС����ͼ2�ⶨ�����������ĺ������ڿ����е�ȼ����ʵ����̣�����仯��ͼ3��ʾ��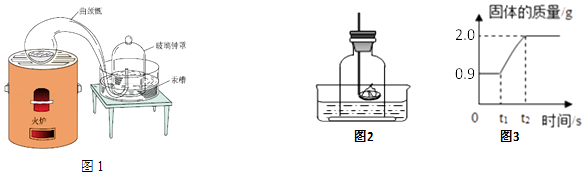
�ٴ�ȼ����������������������t 1ǰû�з����仯��ԭ��Ϊ ��
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ ��
�۲μӷ�Ӧ����������Ϊg��
��4����Ӧ�ýǶȣ����ÿ�����ȡ���ʵ���������ͼ��ʾ�� 
�٢��вμӷ�Ӧ�ĵ��ʼ�Ϊ ��
�ڢ��з�Ӧ�Ļ�ѧ����ʽΪ ��
����������Ԫ�ػ��ϼ۷����仯�ķ�Ӧ��Ϊ������ԭ��Ӧ����Ӧ��������ڡ������ڡ���������ԭ��Ӧ��
��5���ӻ����Ƕȣ����б���������ʩ�������� ��
A.����ͨ���Ӹ��̴�ֱ���ŷŷ���
B.�ƹ�ʹ���Ҵ����ʹ�����ͨ����
C.�ᳫ���С������г��ȡ���̼�����з�ʽ��
���𰸡�
��1�������
��2��C
��3��������ABC���¶�δ�ﵽ�����Ż�㣻4P+5O2 ![]() 2P2O5��1.1
2P2O5��1.1
��4��������4NH3+5O2 ![]() 4NO+6H2O������
4NO+6H2O������
��5��BC
���������⣺��1�������к���������������������̼�����ʣ����ڻ�����2������Լռ������������֮һ��A������ռ���֮����B������ռ���֮�ģ�C��ռ���֮һ����ѡC����3������Һ̬������������������Һ����Һ���ķе㲻ͬ��Һ���ķе�ͣ��������������� ��ʵ����ѡ��ʹ�ù����ŵ����ڹ�������Һ�����ã����ɵĻ�������ȷֽ����ܵõ������������ܽ��ܱ�װ���ڿ����е����������ľ�����ѡABC���ٴ�ȼ����������������������t1ǰû�з����仯��ԭ��Ϊ�¶�δ�ﵽ�����Ż�㣻�ں�����������ȼ���������������ף���Ӧ�Ļ�ѧ����ʽΪ��4P+5O2 ![]() 2P2O5 �� �۴�ͼʾ������0.9g��ʾ��Ӧǰ��������������Ǻ���������2.0g��ʾ��Ӧ��������������������������������2.0g��0.9g=1.1g�ͱ�ʾ�μӷ�Ӧ����������������4���ٵ�����������һ�����������ɰ������٢��вμӷ�Ӧ�ĵ��ʼ�Ϊ�������ڢ��з�Ӧ�Ļ�ѧ����ʽΪ��4NH3+5O2
2P2O5 �� �۴�ͼʾ������0.9g��ʾ��Ӧǰ��������������Ǻ���������2.0g��ʾ��Ӧ��������������������������������2.0g��0.9g=1.1g�ͱ�ʾ�μӷ�Ӧ����������������4���ٵ�����������һ�����������ɰ������٢��вμӷ�Ӧ�ĵ��ʼ�Ϊ�������ڢ��з�Ӧ�Ļ�ѧ����ʽΪ��4NH3+5O2 ![]() 4NO+6H2O���۵�Ԫ�ط�Ӧǰ���ϼ�Ϊ+2�ۣ���Ӧ�ϼ�Ϊ+5�ۣ���Ԫ�ط�Ӧǰ���ϼ�Ϊ0�ۣ���Ӧ�ϼ�Ϊ��2�ۣ���Ӧ������������ԭ��Ӧ����5��A����������ͨ���Ӹ��̴��ŷŷ��������ܷ�ֹ�γ����꣬�ʴ���
4NO+6H2O���۵�Ԫ�ط�Ӧǰ���ϼ�Ϊ+2�ۣ���Ӧ�ϼ�Ϊ+5�ۣ���Ԫ�ط�Ӧǰ���ϼ�Ϊ0�ۣ���Ӧ�ϼ�Ϊ��2�ۣ���Ӧ������������ԭ��Ӧ����5��A����������ͨ���Ӹ��̴��ŷŷ��������ܷ�ֹ�γ����꣬�ʴ���
B���ƹ�ʹ���Ҵ����ʹ�����ͨ���ͣ����Խ�Լ��Դ�����ٿ�����Ⱦ������ȷ��
C���ᳫ���С������г��ȡ���̼�����з�ʽ�����Լ��ٶ�����̼���ŷţ�����ȷ��
�𰸣���1��������2��C����3��������ABC�����¶�δ�ﵽ�����Ż�㣻��4P+5O2 ![]() 2P2O5 �� ��1.1����4������������4NH3+5O2
2P2O5 �� ��1.1����4������������4NH3+5O2 ![]() 4NO+6H2O�������ڣ���5��BC��
4NO+6H2O�������ڣ���5��BC��
�����㾫�������÷��ο�����Ⱦ�Ĵ�ʩ����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪������Ⱦ��������ǿ����������⣬���ƻ���״����ʹ�������Դ�������ķ�����������������ŷţ�����ֲ�������֡��ֲݵȣ�ע�⣺a����ƽ b������ c�����ţ�