题目内容
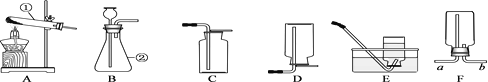
【题目】利用下列提供的仪器装置回答问题:
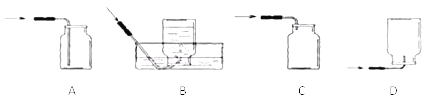
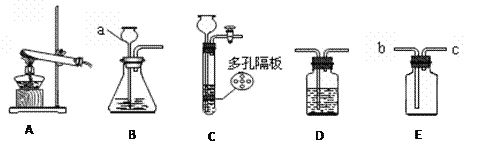
①仪器名称:A为_____
②小丽用双氧水和二氧化锰制取氧气时,发现反应速率过快,小丽思考后将所用仪器B改为_____,该反应的化学方程式为_____,若使用装置G收集氧气,氧气应从_____(填“a”或“b”)端通入。
③小明选用A到G中仪器,组装出实验室制取二氧化碳装置,他所选仪器有_____(填写一套即可),反应的化学方程式为_____。
④小刚选用H装置放入锌粒和稀硫酸制取氢气,H装置的优点是_____,反应一段时间后他关闭活塞,发现装置中固液无法分离,原因可能为_____(写出一种即可);
⑤小刚用制得的氢气还原氧化铜,得到0.1mol铜,则理论上参与反应的氢气的质量为_____(根据化学方程式计算)。
【答案】 锥形瓶 分液漏斗 2H2O2![]() 2H2O+O2↑ a ABCE CaCO3+2HCl═CaCl2+H2O+CO2↑ 能控制反应的发生和停止 硫酸反应完了 0.2g
2H2O+O2↑ a ABCE CaCO3+2HCl═CaCl2+H2O+CO2↑ 能控制反应的发生和停止 硫酸反应完了 0.2g
【解析】①仪器A的名称为锥形瓶;
②仪器B是分液漏斗,该仪器不能控制反应的速率,将长颈漏斗改为分液漏斗可以控制加入过氧化氢的速率,从而可以控制反应的速率;该反应是过氧化氢在二氧化锰作催化剂的条件下反应生成氧气和水,反应方程式为2H2O2 MnO2 2H2O+O2↑;装置G是多功能装置,此处改装为排水法收集氧气,由于氧气的密度比水的密度小,故氧气由短管通入,即由a端通入;
③实验室制取二氧化碳是用碳酸钙和稀盐酸反应制取,该反应的反应物的状态是固体和液体,反应的条件是不加热,故选固液不加热型装置,可以选ABCE(或ADE);反应方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O ;
④H装置在试管中放有隔板,该装置的优点是能控制反应的发生和停止(随开随用,随关随停);反应一段时间后关闭活塞,发现装置中固液无法分离,可能是由于硫酸反应完了,也可能是装置漏气,不能将液体压入长颈漏斗中;
⑤设生成0.1mol的铜需要氢气的量为x
H2 +CuO△Cu+H2O
1 1
X 0.1mol
![]() =
=![]() 求得x=0.1mol
求得x=0.1mol
所以生成氢气的质量为0.1![]() =0.2g
=0.2g

 天天向上口算本系列答案
天天向上口算本系列答案【题目】实验室利用不同的装置制取得到不同的气体。下图是实验室制取气体的各种装置。
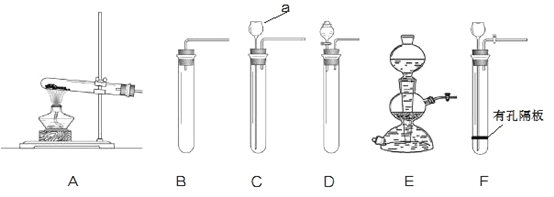
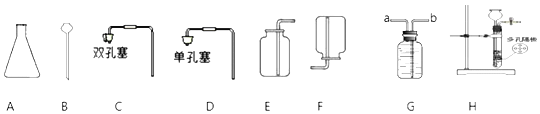
①图中仪器“a”的名称是______。制取气体的装置,放入药品前,均需对装置进 行______检查。
②上述装置按照不同角度可以分为两类,完成表格空白处:
分类依据 | 装置编号 | |
反应条件 | 加热 | A |
不加热 | BCDEF | |
(3) | 固体与固体 | A |
固体与液体 | BCDEF | |
若将“BCDEF”继续分为两类:“BCD”和“EF”两类,“EF”放在一起的理由是:________。
③如果实验室利用氯化铵固体与氢氧化钙固体在加热条件下得到氨气,选用的装置可以是______(选填图中装置编号);实验室利用大理石与稀盐酸反应制取 CO2,若要得到较 多的气体,装置宜选用_______(选填图中装置编号)。
④实验室利用大理石与稀盐酸反应制取 CO2,反应中共消耗了 3.65%的稀盐酸 100g,计算该 盐酸溶液中含 HCl 的物质的量是多少?可以得到 CO2 气体的质量是多少________?(请列式计算)
(7)计算 HCl 的物质的量:_______
(8)计算 CO2 气体的质量:________。