题目内容
为测定某黄铜样品中锌的含量,某同学称取20g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100g质量分数为9.8%的稀硫酸,请计算:(1)该黄铜样品中锌的质量.
(2)反应后所得溶液的溶质质量分数(计算结果保留0.1%).
【答案】分析:向黄铜中加入稀硫酸,黄铜中的锌与硫酸发生反应.
(1)根据参加反应硫酸的质量求出锌的质量.
(2)反应后所得溶液的溶质质量分数= %,溶质是硫酸锌,可根据硫酸的质量求出,反应后所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量.
%,溶质是硫酸锌,可根据硫酸的质量求出,反应后所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量.
解答:解:100g9.8%的稀硫酸中含纯硫酸的质量为100g×9.8%=9.8g
(1)设黄铜样品中锌的质量为x,生成硫酸锌的质量为y,充分反应后生成氢气的质量为z.
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
x 9.8g y z

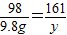

x=6.5g y=16.1g z=0.2g
答:黄铜样品中锌的质量为 6.5g.
(2)反应后所得溶液中溶质的质量分数= %=15.1%
%=15.1%
答:反应后所得溶液中溶质的质量分数为15.1%
点评:反应后所得溶液的质量的计算是一个难点,但只要掌握好方法,所有的问题都会迎韧而解.反应后所得溶液的质量=所加入的所有物质的质量-气体的质量-沉淀的质量.
(1)根据参加反应硫酸的质量求出锌的质量.
(2)反应后所得溶液的溶质质量分数=
 %,溶质是硫酸锌,可根据硫酸的质量求出,反应后所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量.
%,溶质是硫酸锌,可根据硫酸的质量求出,反应后所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量.解答:解:100g9.8%的稀硫酸中含纯硫酸的质量为100g×9.8%=9.8g
(1)设黄铜样品中锌的质量为x,生成硫酸锌的质量为y,充分反应后生成氢气的质量为z.
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
x 9.8g y z

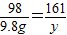

x=6.5g y=16.1g z=0.2g
答:黄铜样品中锌的质量为 6.5g.
(2)反应后所得溶液中溶质的质量分数=
 %=15.1%
%=15.1%答:反应后所得溶液中溶质的质量分数为15.1%
点评:反应后所得溶液的质量的计算是一个难点,但只要掌握好方法,所有的问题都会迎韧而解.反应后所得溶液的质量=所加入的所有物质的质量-气体的质量-沉淀的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目