题目内容
下列化学方程式中,书写正确的是
- A.Zn+2HNO3=Zn(NO3)2+H2↑
- B.Cu+2HCl=CuCl2+H2↑
- C.Zn(OH)2+2HCl=ZnCl2+2H2O
- D.2Fe+6HCl=2FeCl3+3H2↑
C
分析:A、根据硝酸具有强氧化性进行分析;
B、根据金属活动性顺序进行分析;
C、根据复分解反应的原理进行分析;
D、根据铁在置换反应中常显+2价进行分析.
解答:A、硝酸具有强氧化性,与活泼金属反应生成水而不会生成氢气,正确的方程式为:Zn+4HNO3=Zn(NO3)2+2H2O+2NO2↑,故A错误;
B、铜的活动性排在氢之后,不会置换出酸中的氢,故B错误;
C、该方程式应用原理正确,化学式符合客观规律,满足质量守恒定律,故C正确;
D、铁在置换反应中一般显+2价,正确的方程式为:Fe+2HCl=FeCl2+H2↑,故D错误;
故选C.
点评:在解此类题时,首先分析应用的原理是否正确,然后再根据方程式的书写规则进行分析.
分析:A、根据硝酸具有强氧化性进行分析;
B、根据金属活动性顺序进行分析;
C、根据复分解反应的原理进行分析;
D、根据铁在置换反应中常显+2价进行分析.
解答:A、硝酸具有强氧化性,与活泼金属反应生成水而不会生成氢气,正确的方程式为:Zn+4HNO3=Zn(NO3)2+2H2O+2NO2↑,故A错误;
B、铜的活动性排在氢之后,不会置换出酸中的氢,故B错误;
C、该方程式应用原理正确,化学式符合客观规律,满足质量守恒定律,故C正确;
D、铁在置换反应中一般显+2价,正确的方程式为:Fe+2HCl=FeCl2+H2↑,故D错误;
故选C.
点评:在解此类题时,首先分析应用的原理是否正确,然后再根据方程式的书写规则进行分析.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
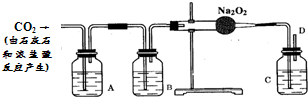
 小勇看书得知:潜水艇中常用过氧化钠(Na2O2)作为供给人们呼吸的试剂.
小勇看书得知:潜水艇中常用过氧化钠(Na2O2)作为供给人们呼吸的试剂.
[提出问题]CO2跟Na2O2反应产生的气体是O2吗?
[猜想与假设]CO2跟Na2O2反应产生的气体是O2.
[查阅资料]①Na2O2是一种化学性质活泼的淡黄色颗粒状固体,在通常情况下能分别跟H2O和盐酸等发生化学反应,有O2生成.
②CO2能与Na2CO3水溶液反应生成NaHCO3,CO2在NaHCO3溶液中几乎不溶解;NaHCO3与盐酸反应生成NaCl、H2O和CO2.
[实验探究]小勇设计了如下图所示装置进行探究活动.
[请你参加]请你参加小明的实验探究活动,回答下列问题.
(1)
| 瓶内液体 | 作用 | 发生反应的化学方程式 | |
| A装置 | |||
| B装置 | |||
| C装置 |
[探究结论]原假设正确.
 11、如今,青少年近视的人越来越多,我们青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具.请根据图回答下列问题:
11、如今,青少年近视的人越来越多,我们青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具.请根据图回答下列问题: (2007?石景山区二模)小勇看书得知:潜水艇中常用过氧化钠(Na2O2)作为供给人们呼吸的试剂.
(2007?石景山区二模)小勇看书得知:潜水艇中常用过氧化钠(Na2O2)作为供给人们呼吸的试剂.