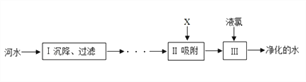
题目内容
【题目】下图①②是氧元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
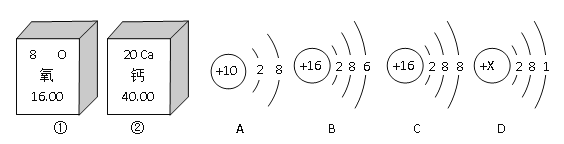
(1)氧的相对原子质量为_______;氧元素与钙元素的本质区别是_______________
(2)D中的X = _________;
(3)以上A、B、C、D粒子结构示意图中,表示稀有气体元素的原子的是_____________;表示离子的是________________(用离子符号填空)
(4)①的原子和________化学性质相似(用“A”、“B”、“C”、“D”填空)。
(5)①②形成的化合物的化学式为______________
【答案】16.00质子数(核电荷数)不同11AS2-BCaO
【解析】(1)氧的相对原子质量是16.00 ,一种元素与另一种元素的本质区别是质子数不同。 (2).原子中质子数=核外电子数,故x=2+8+1=11。(3)稀有气体原子最外层是8个电子(氦是2个)。质子数不等于核外电子数的微粒是离子,离子符号的写法是在元素符号的右上方先写电荷数,再写正负号。(4)最外层电子数相同的原子化学性质相似。(5)①是氧元素,②是钙元素,它们形成的化合物的化学式是CaO

 考前必练系列答案
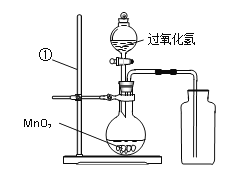
考前必练系列答案【题目】在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水。某化学课外兴趣小组对碳的氧化物的成分进行了实验探究。
【提出问题】如何通过实验确定碳的氧化物的成分。
【收集资料】a.浓硫酸有吸水性,可用于干燥某些气体;
b.氢氧化钠溶液能与CO2反应,可除去CO2气体。
【猜想】
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有_______ | CO和CO2都有 |
【设计实验】基于猜想3,兴趣小组同学设计了如下实验装置:
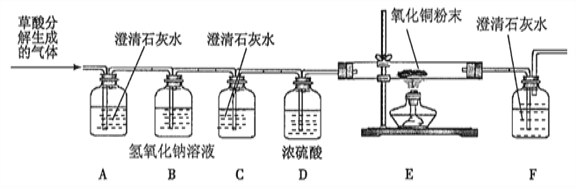
【实验探究】
①实验过程中观察到______________装置(填字母)中的澄清石灰水变浑浊,证明有CO2气体。
②实验过程中还观察到以下实验现象:Ⅰ.C装置中澄清石灰水不变浑浊;Ⅱ.E装置
中_____________;Ⅲ._____________装置中的澄清石灰水变浑浊,证明有CO气体。
【实验结论】通过实验探究证明:猜想3成立。
【问题讨论】①有同学想验证草酸分解是否有氢气生成,则需在上述装置中的合适位置添加适当的仪器和药品,具体做法是____________________。
②C装置的作用是_________________;该实验装置还需完善之处是_______________。
【计算】若有4.4g的二氧化碳通入到足量的澄清石灰水中,则理论上可以得到沉淀的物质的量为多少摩尔?(根据化学方程式列式计算)__________________
【题目】下表是KNO3 、NaCl在不同温度下的部分溶解度数据,请回答问题:
温度(℃) | 10 | 20 | 40 | 60 | 80 |
KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
① 10℃时,NaCl 溶解度是__________。
② 在20℃时,将50克硝酸钾溶解在100克水中,形成的是__________(填“饱和”或“不饱和”)溶液,若升温至40℃,形成的溶液质量为_________g,则烧杯中溶液的溶质质量分数为__________(精确到0.1%)
③ 某温度时,氯化钠与硝酸钾的溶解度相等,则溶解度的最小取值范围是__________。
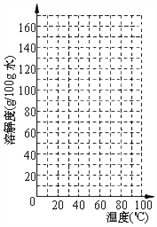
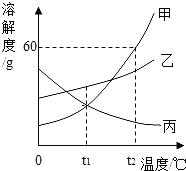
④ 根据表中数据,请在坐标图中描点、绘制符合KNO3溶解度变化规律的曲线__________。
⑤ 固体硝酸钾中混有少量氯化钠可以通过溶解、蒸发浓缩、降温结晶、过滤等步骤分离提纯硝酸钾。可以利用该方法分离的理由是__________。
Ⅰ. 固体混合物中硝酸钾的含量较高,氯化钠的含量较低
Ⅱ. 硝酸钾的溶解度受温度影响变化较大
Ⅲ. 40℃至100℃,硝酸钾的溶解度始终大于氯化钠
⑥ 气体的溶解度也有一定的变化规律。不同温度下,氧气的溶解度随压强变化如右图所示,图中t2对应的温度为30℃,则t1对应的温度_________。
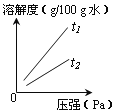
A.小于30℃ B.等于30℃ C.大于30℃ D.无法确定