题目内容
【题目】(6分)“对比实验”是化学学习中行之有效的思维方法。某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下实验,请你参与并回答下列问题。
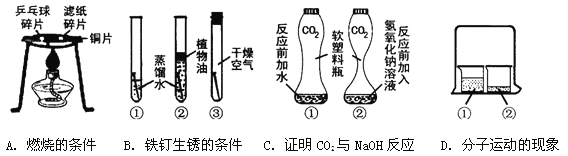
(1)通过实验A,可以说明燃烧的条件之一是 。
(2)对于实验B,一段时间后观察到试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与水
和 直接接触。欲除去铁锈可用 洗的方法,
(3)实验C是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2 与NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为 。
(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的。当烧杯①中液体是浓氨水时烧杯②中的酚酞溶液由无色变为 色;当烧杯①中液体换成浓盐酸,且烧杯②中液体换成滴有酚酞的NaOH溶液时,一段时间后,溶液颜色的变化是 。
【答案】(1)达到燃烧所需的最低温度(或达到着火点)
(2)氧气(或空气) 稀盐酸(或稀硫酸)
(3)CO2 + 2NaOH =Na2CO3 + H2O
(4)红色 红色逐渐变成无色
【解析】
试题分析:(1)A实验中铜片上的碎纸片先燃烧,乒乓球碎片后燃烧,说明燃烧的条件是可燃物要得到着火点;
(2)试管1 中的条件是水和氧气,试管2 中的条件是水,试管3 中的条件是氧气,试管1 中的铁生锈了,说明铁生锈的条件是与水和氧气同时接触;铁锈的主要成分是氧化铁,氧化铁能与酸反应,一般用稀盐酸或稀硫酸来除铁锈;
(3)二氧化碳与氢氧化钠反应生成的是碳酸钠和水:CO2 + 2NaOH =Na2CO3 + H2O;
(4)氨气溶于水形成氨水,氨水呈碱性,能使无色酚酞试液变红;氢氧化钠溶液呈碱性能使无色酚酞试液变红,稀盐酸挥发出的氯化氢气体溶于水形成盐酸,盐酸与氢氧化钠发生中和反应,故溶液会由红色变成无色。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案