题目内容
小明对铁丝在氧气中燃烧为什么会火星四射进行探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析回答:
①表格中“未填”的实验现象是 .
②引起该现象的原因是 .
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | (未填) |
②引起该现象的原因是
考点:氧气的化学性质
专题:氧气、氢气的性质与用途
分析:通过对比可知铁丝含碳越高,火星越多,所以铁丝在氧气中燃烧产生火星四射现象与含碳量有关.
解答:解:①由前三项对比可知铁丝含碳量越高火星越多,故答案为:剧烈燃烧,火星四射;
②由实验现象可以看出,当铁丝中含碳量越多时,燃烧时火星就越多,因此铁丝燃烧火星四射是由里面的炭引起的,故答案为:铁丝中含有的碳引起的.
②由实验现象可以看出,当铁丝中含碳量越多时,燃烧时火星就越多,因此铁丝燃烧火星四射是由里面的炭引起的,故答案为:铁丝中含有的碳引起的.
点评:本题通过对比实验探究考查铁丝燃烧的现象,同时要求能从探究中学会对比分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
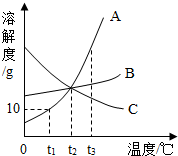 如图是A、B、C、三种物质的溶解度曲线,据图回答以下问题:
如图是A、B、C、三种物质的溶解度曲线,据图回答以下问题: