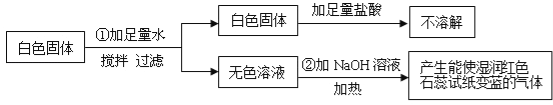
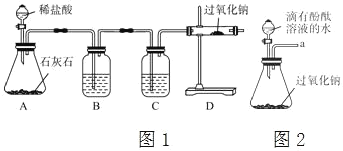
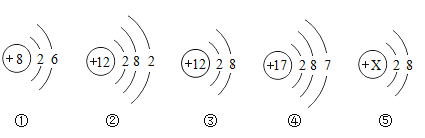
题目内容
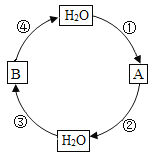
【题目】甲、乙、丙三种物质的溶解度曲线如图所示。据图回答:

(1)30℃时,丙物质的溶解度是_____。
(2)12℃时,甲和丙的溶解度曲线相交于a点,a点的意义是_____。
(3)要使接近饱和的丙物质溶液变为饱和溶液,可采取的一种措施是_____(写出一种方法即可)
(4)30℃时,三种物质的溶解度由大到小的顺序为_____。
(5)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,析出晶体最多的是_____,所得溶液中溶质质量分数最小的是_____。
(6)甲中含少量乙,要提纯甲,应该用_____方法。
【答案】10g 12℃时,甲和丙的溶解度相等 升高温度(或增加溶质) 乙>甲>丙 甲 丙 降温结晶
【解析】
由甲、乙、丙三种物质的溶解度曲线图可知,甲物质的溶解度随温度的升高而增大,乙物质的溶解度受温度的影响较小,丙物质的溶解度随温度的升高而减小。
(1)由甲、乙、丙三种物质的溶解度曲线图可知,30℃时,丙物质的溶解度是10g。
(2)12℃时,甲和丙的溶解度曲线相交于a点,a点的意义是12℃时,甲和丙的溶解度相等。
(3)丙物质的溶解度随温度的升高而减小,要使接近饱和的丙物质溶液变为饱和溶液,可采取的措施是升高温度、增加溶质。
(4)由甲、乙、丙三种物质的溶解度曲线图可知,30℃时,三种物质的溶解度由大到小的顺序为乙>甲>丙。
(5)甲物质的溶解度随温度的升高而增大,乙物质的溶解度受温度的影响较小,丙物质的溶解度随温度的升高而减小,50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,甲析出晶体较多,乙有少量的晶体析出,丙没有晶体析出,故析出晶体最多的是甲;50℃时,甲、乙、丙的溶解度关系为甲>乙>丙,10℃时,甲、乙、丙的溶解度关系为乙>甲=丙,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,甲的溶质质量分数变小,乙的基本不变,丙的溶质质量分数不变,故所得溶液中溶质质量分数最小的是丙。
(6)甲物质的溶解度随温度的升高而增大,乙物质的溶解度受温度的影响较小,甲中含少量乙,要提纯甲,应该用降温结晶方法。