题目内容
【题目】小明同学设计以下实验来探究可燃物燃烧的条件和测定空气中氧气的含量。(已知:白磷的着火点是40℃,红磷的着火点是240℃。)
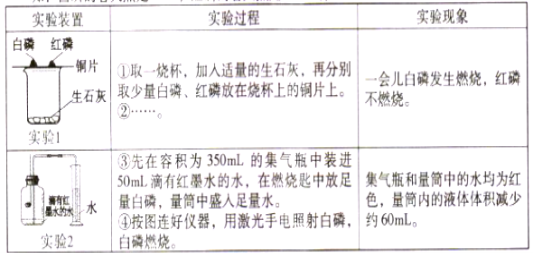
(1)实验过程②是___________,烧杯中发生反应的化学方程式为_________________。
(2)白磷燃烧反应的化学方程式为_________________________________。
(3)根据实验2的结果,计算空气中氧气的体积分数约为__________(写出计算式和结果)。
(4)在整个实验2的过程中,集气瓶内的压强变化是______________。集气瓶中预先装入50mL水,水起的作用是_________________________。
【答案】(1)向烧杯中加入适量的冷水 CaO + H2O=Ca(OH)2
(2)4P + 5O2![]() 2P2O5
2P2O5
(3)60/(350-50)=1/5
(4)先变大后变小到与大气压相等 防止集气瓶内的空气因瓶内温度升高、压强增大而泄出瓶外
【解析】
试题分析:(1)实验过程②是:向烧杯中加入适量的冷水,利用氧化钙与水反应放出大量的热来提供热量,从而达到白磷的着火点;发生反应的化学方程式为:CaO + H2O=Ca(OH)2
(2)白磷燃烧反应的化学方程式为:4P + 5O2点燃2P2O5
(3)集气瓶的总容积为350mL,但由于事先加了50mL红墨水,即反应前只有300mL的空气,故根据实验2的结果,计算空气中氧气的体积分数约为:60/(350-50)=1/5
(4)在整个实验2的过程中,由于刚开始白磷燃烧放热,使集气瓶内的气体膨胀,压强增大,待冷却,氧气被消耗,瓶内气体量减少,压强又降低,打开止水夹,水进入集气瓶,这是压强由于大气压相等,故集气瓶内的压强变化是:先变大后变小到与大气压相等;集气瓶中预先装入50mL水,水起的作用是:防止集气瓶内的空气因瓶内温度升高、压强增大而泄出瓶外

