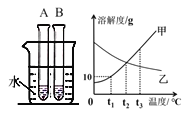
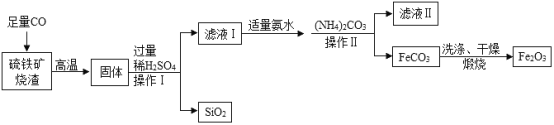
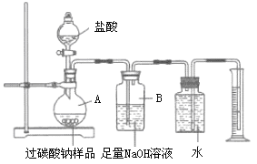
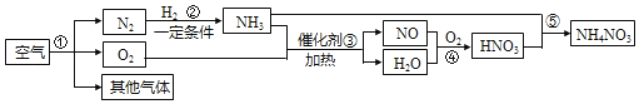
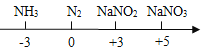题目内容
【题目】某兴趣小组在一个充满O2的密闭容器中加入一定量的碳粉,高温下使其充分反应,待反应结束后,碳粉完全消失。小组成员对容器中反应后的气体成分进行如下探究:
(提出猜想)
小红对容器中的气体提出如下猜想,你认为猜想不合理的是_____(填字母)。
A 只有CO2 B 只有CO C CO和O2的混合气体
小明猜想容器中的气体可能是CO和CO2的混合气体;小强猜想可能是CO2和O2的混合气体。小明和小强均开展了以下实验探究来验证自己的猜想是否正确。
(实验探究1)小明为了验证自己的猜想,按如图所示装置进行探究。
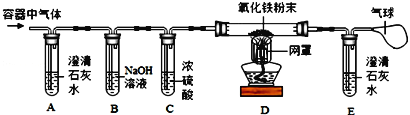
请回答下列问题:
(1)装置B中NaOH溶液的作用是_____。
(2)若小明的猜想成立,则装置A中的实验现象是_____;装置D玻璃管中的实验现象是_____,反应的化学方程式为_____。
(实验探究2)小强把小明实验中的氧化铜换成了铜丝网,并去掉E装置验证其猜想。
若小强的猜想成立,则装置D中的实验现象是_____。
(反思交流)小张认为,小明应先通气体一段时间方可加热,原因是_____。
【答案】C 除去CO2气体 澄清石灰水变浑浊 红色粉末变成黑色 Fe2O3+3CO![]() 2Fe+3CO2 红色粉末变成黑色 排净玻璃管中的空气,排除空气中氧气的干扰
2Fe+3CO2 红色粉末变成黑色 排净玻璃管中的空气,排除空气中氧气的干扰
【解析】
[提出猜想] CO和O2点燃的条件下会继续反应,不会共存,故C错;
[实验探究1](1)装置B中NaOH溶液的作用是除去空气中的二氧化碳,故填:除去空气中的二氧化碳;
(2)若小明的猜想成立,则装置A中的实验现象是澄清石灰水变浑浊;装置D玻璃管中的实验现象是红色粉末变成黑色,反应的化学方程式是:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
.[实验探究2]如果氧气过量,则乙容器中气体的组成是CO2和O2的混合气体;加热条件下,铜能和氧气反应生成氧化铜,所以红色粉末变成黑色;故填:红色粉末变成黑色;
[反思交流]应先通入乙中气体一段时间后方可加热,这样修改的原因是排净玻璃管中的空气,排除空气中氧气的干扰;故填:排净玻璃管中的空气,排除空气中氧气的干扰.

 阅读快车系列答案
阅读快车系列答案【题目】如图是实验室制取气体的常用仪器。请根据要求填空:
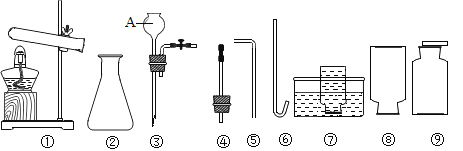
(1)图中仪器名称是⑧___________________________。
(2)小宝同学用氯酸钾和二氧化锰制取并收集一瓶干燥的氧气,应选择上图中的仪器________________(填序号,下同),其化学方程式为:______________________; 验证瓶中氧气已集满的方法是___。
(3)小茹同学用锌和稀硫酸制取 H2,则应选择图中仪器___________组成发生装置, 其化学方程式为:_____________________。
(4)小佳同学查阅资料得到制取硫化氢气体的如下信息,请回答下列问题:
气体 | 实验药品 | 反应条件 | 气体物理性质 |
H2S | 硫化亚铁固体与稀硫酸 | 不需加热 | 无色,密度比空气大,可溶于水 |
①制取 H2S 时不选择发生装置_____________(填代号),理由是_______________________。
②收集 H2S___________________________(填“可以”或“不可以”)采用仪器⑥和⑦组成收集装置。