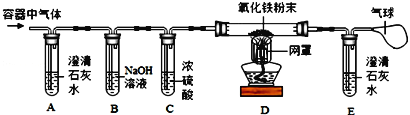
题目内容
【题目】甲、乙、丙三种物质在水中的溶解情况与温度的关系如图所示。
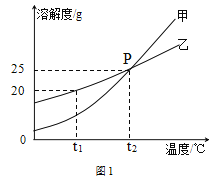
(1)P点的意义为_________________________________。
(2)t1℃时,将20g乙投入50g水中,所得溶液质量为________。
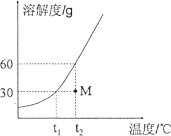
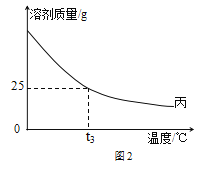
(3)10g丙在不同温度时配成饱和溶液,所需溶剂质量如图2所示。则t3℃时,该物质的溶解度为__________。
(4)下列说法正确的________(填序号)。
A.甲、乙、丙三种物质的溶解度随温度的升高而增大
B.t1℃时,甲溶液的溶质质量分数小于乙溶液
C.t2℃时,将50g乙的饱和溶液稀释成10%的溶液,需加水125g
D.将丙的饱和溶液变为不饱和溶液,溶质质量分数一定减小
【答案】t2℃时,甲、乙的溶解度相同 60g 40g A
【解析】
(1)在溶解度曲线图上,横坐标是温度,纵坐标是溶解度,P点的意义为t2℃时,甲、乙的溶解度相同;
(2)溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。t1℃时,乙的溶解度为20g,将20g乙投入50g水中,充分溶解后,乙只能溶解10g,所得溶液质量为60g;
(3)10g丙在不同温度时配成饱和溶液,所需溶剂质量从图2可知为25g。则t3℃时,100g水中最多溶解丙40g,该物质的溶解度为40g;
(4)A.由图1可知甲、乙的溶解度随温度的升高而增大,由图2可知,10g丙完全溶解且配成饱和溶液需要的水随温度升高而减少,说明温度升高,丙的溶解度增大,正确;B.t1℃时,甲的溶解度小于乙的溶解度,则.t1℃时甲的饱和溶液的溶质质量分数小于乙的饱和溶液,错误;C.由图1可知,t2℃时,乙的溶解度为25g,则其饱和溶液的溶质质量分数为25g÷(100g+25g)×100%=20%,设将50g乙的饱和溶液稀释成10%的溶液,需加水的质量为x,则50g×20%=(50g+x)×10%,x=50g,错误;D.将丙的饱和溶液变为不饱和溶液,可以通过降温的方法实现,该过程中,溶液、溶质的质量均没有改变,溶质质量分数也不变,错误。故选A。

【题目】如下图(夹持仪器已略),某兴趣小组在老师指导下,探究铁与水蒸气的反应,请回答。
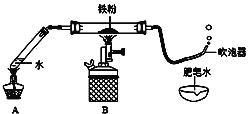
【实验初探】
(1)连接装置,并___________。
(2)装好药品。
(3)加热一段时间后,吹泡器连续吹出气泡,且气泡向上飞起,用燃着的木条靠近气泡,能产生爆鸣。
该气体燃烧的化学方程式为________。
【查阅资料】铁有三种氧化物(FeO、Fe2O3、Fe3O4)。
①它们都不溶于水,其中铁粉、Fe3O4能被磁铁吸引;②FeO接触到空气会立即由黑色变为红棕色;③三种氧化物都不与硫酸铜溶液反应,但能与酸反应生成可溶性物质。
【实验探究】实验小组同学对反应后的剩余固体进行探究。
(1)小梅发现固体为黑色,由此判断:固体中肯定不存在Fe2O3 ,理由是_______。
(2)小宇发现固体均能被磁铁吸引,大家倒出玻璃管中黑色固体,平铺于白纸上。观察现象是__________,判断黑色固体中一定没有FeO。
讨论:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
【提出猜想】玻璃管中黑色固体成分有什么?
猜想Ⅰ:Fe; 猜想Ⅱ:Fe3O4; 猜想Ⅲ:______________
实验步骤 | 实验现象 | 实验结论 |
取上述固体少许,加入足量 _________________ | 出现红色固体,且有黑色固体残留 | 黑色固体中一定含有 ________________ |
【结论反思】(1)铁与水蒸气发生置换反应,反应的方程式是________________。
(2)出现红色固体的化学方程式是_______,加入的溶液必须足量的原因是______________。