题目内容
某同学对“菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石”的说法产生了兴趣。
探究一 菠菜里是否含有可溶性草酸盐和碳酸盐?
【查阅资料】
(1)可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。
(2)醋酸(化学式用HAc表示)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。
【实验流程】
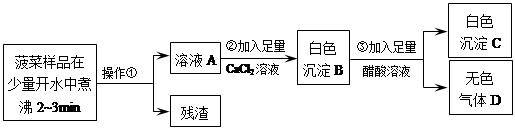
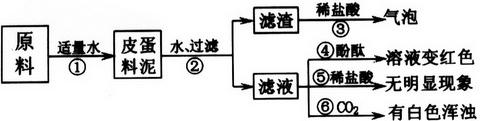
根据流程回答问题: 1)操作①是_____。 2)加入足量CaCl2溶液的目的是_____。
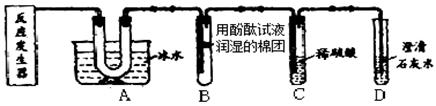
(3)已知气体D能使澄清石灰水变浑浊,步骤③的化学反应方程式为_____。
【实验结论】菠菜里含有可溶性草酸盐和碳酸盐。
探究二 人体结石的主要成分是草酸钙,草酸钙高温分解的产物是什么?
【查阅资料】
(1)草酸钙高温完全分解得到两种气态氧化物和一种固态氧化物。
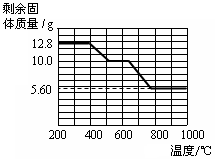
(2)12.8 g的草酸钙分解过程中温度与剩余固体的质量关系如右图所示。
【实验分析】
(1)草酸钙高温完全分解的化学方程式为_____。(2)通过上图数据分析,700℃时剩余固体的成分是_____。
请你设计实验,验证700℃时剩余固体的成分。
探究一 菠菜里是否含有可溶性草酸盐和碳酸盐?
【查阅资料】
(1)可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。
(2)醋酸(化学式用HAc表示)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。
【实验流程】

根据流程回答问题: 1)操作①是_____。 2)加入足量CaCl2溶液的目的是_____。
(3)已知气体D能使澄清石灰水变浑浊,步骤③的化学反应方程式为_____。
【实验结论】菠菜里含有可溶性草酸盐和碳酸盐。
探究二 人体结石的主要成分是草酸钙,草酸钙高温分解的产物是什么?
【查阅资料】
(1)草酸钙高温完全分解得到两种气态氧化物和一种固态氧化物。
(2)12.8 g的草酸钙分解过程中温度与剩余固体的质量关系如右图所示。

【实验分析】
(1)草酸钙高温完全分解的化学方程式为_____。(2)通过上图数据分析,700℃时剩余固体的成分是_____。
请你设计实验,验证700℃时剩余固体的成分。
| 实验操作 | 实验现象 | 实验结论 |
| | | |
探究一:(1)过滤 (2)将溶液中的草酸根和碳酸根完全沉淀出来
(3)CaCO3 + 2HAc = Ca(Ac)2 + H2O + CO2↑
探究二:(1)CaC2O4 CaO + CO↑+ CO2↑ (2)CaCO3和CaO
CaO + CO↑+ CO2↑ (2)CaCO3和CaO
(3)CaCO3 + 2HAc = Ca(Ac)2 + H2O + CO2↑
探究二:(1)CaC2O4
 CaO + CO↑+ CO2↑ (2)CaCO3和CaO
CaO + CO↑+ CO2↑ (2)CaCO3和CaO| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体于试管中,加入适量的水,用手触摸试管壁;静置后取上层清液,滴加无色酚酞试液。 取不溶物于试管中,加入足量的稀盐酸,将气体通入澄清石灰水。 | 试管壁发烫, 溶液变红 有气泡冒出,澄清石灰水变浑浊。 | 该固体中含有CaO。 该固体中含有CaCO3。 剩余固体的成分为CaO和CaCO3 |
试题分析:【实验流程】
根据流程回答问题: 1)操作①是过滤。 2)加入足量CaCl2溶液的目的是将溶液中的草酸根和碳酸根完全沉淀出来。
(3)若气体D能使澄清石灰水变浑浊,则D是二氧化碳气体,步骤③的化学反应方程式为CaCO3 + 2HAc = Ca(Ac)2 + H2O + CO2↑
【实验分析】
(1)草酸钙高温完全分解的化学方程式为CaC2O4
 CaO + CO↑+ CO2↑。
CaO + CO↑+ CO2↑。(2)通过上图数据分析可知,700℃时剩余固体的成分是CaCO3和CaO。
设计实验,验证700℃时剩余固体的成分。
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体于试管中,加入适量的水,用手触摸试管壁;静置后取上层清液,滴加无色酚酞试液。 取不溶物于试管中,加入足量的稀盐酸,将气体通入澄清石灰水。 | 试管壁发烫, 溶液变红 有气泡冒出,澄清石灰水变浑浊。 | 该固体中含有CaO。 该固体中含有CaCO3。 剩余固体的成分为CaO和CaCO3 |
点评:本题难度较大,要通过实验探究物质的组成,得根据各种物质的性质,结合题中信息,综合考虑,这要求学生有较高的分析和综合能力。

练习册系列答案
相关题目