题目内容
【题目】某同学用氢氧化钠和硫酸做酸碱中和反应。下列实验中溶液的pH随加入试剂体积而变化的关系图。
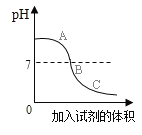
①该实验是____________中逐滴入__________溶液。
②分别写出ABC三点,溶液中的溶质成分:A________;B________;C________。
③写出滴加溶液过程中溶液温度的变化________________。
【答案】氢氧化钠 稀硫酸 NaOH和Na2SO4 Na2SO4 H2SO4和Na2SO4 温度先升高,再降低
【解析】
①根据题目的图像分析可知,该溶液的pH值由大于7逐渐的减小到小于7。溶液的pH大于7,溶液呈碱性。溶液的pH小于7,溶液呈酸性。所以该实验是将酸溶液加入到碱溶液中。故答案为:氢氧化钠、稀硫酸;
②氢氧化钠和硫酸反应生成硫酸钠和水,化学反应方程式为:2NaOH+H2SO4=Na2SO4+2H2O。A点的pH大于7,表示溶液呈碱性,则溶液中的溶质为未被反应完全的氢氧化钠和生成的硫酸钠。B点的pH等于7,表示溶液呈中性,则溶液中的溶质为硫酸钠。C点的pH小于7,表示溶液呈酸性,则溶液中的溶质为过量的硫酸和生成硫酸钠。故答案为:NaOH和Na2SO4、Na2SO4、H2SO4和Na2SO4;
③硫酸是酸,氢氧化钠是碱。该反应是中和反应,中和反应放出热量,随着反应的结束,溶液的温度逐渐冷却到室温。故答案为:温度先升高,再降低。

练习册系列答案
相关题目