题目内容
100g硫酸铜溶液中放入5.6g铁粉恰好完全反应.试计算:
(1)生成铜的质量;
(2)硫酸铜溶液中溶质的质量分数;
(3)反应后所得溶液中溶质的质量分数(精确到0.1%)
解:(1)设生成铜的质量为x,生成FeSO4的质量为y,参加反应的硫酸铜的质量为z.
Fe+CuSO4═FeSO4+Cu
56 160 152 64
5.6g z y x
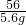 =
=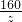 =
= =
=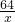
解得:x=6.4g,y=15.2g,z=16g;
(2)根据质量分数公式,硫酸铜溶液中溶质的质量分数为: ×100%=16%;
×100%=16%;
(3)根据质量守恒定律,反应后所得溶液的质量为:100g+5.6g-6.4g=99.2g,
则反应后所得溶液的溶质质量分数为: ×100%=15.3%.
×100%=15.3%.
答:(1)生成铜的质量为6.4g;(2)硫酸铜溶液中溶质的质量分数16%;(3)反应后所得溶液的溶质质量分数为15.3%.
分析:(1)(2)先根据铁与硫酸铜反应的方程式以及铁的质量,列比例式即可求得反应生成的铜、硫酸铜以及硫酸亚铁的质量;
(3)根据质量守恒定律求得反应后溶液的质量,利用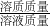 ×100%即可求得反应后所得溶液的溶质质量分数.
×100%即可求得反应后所得溶液的溶质质量分数.
点评:本题考查了质量分数的计算以及根据化学方程式的简单计算,写好化学方程式是解题的关键.注意化学变化都遵循质量守恒定律,质量守恒定律的灵活使用,对于解答此类问题会有很大帮助,甚至起到决定性作用.
Fe+CuSO4═FeSO4+Cu
56 160 152 64
5.6g z y x
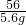 =
=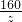 =
= =
=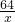
解得:x=6.4g,y=15.2g,z=16g;
(2)根据质量分数公式,硫酸铜溶液中溶质的质量分数为:
 ×100%=16%;
×100%=16%;(3)根据质量守恒定律,反应后所得溶液的质量为:100g+5.6g-6.4g=99.2g,
则反应后所得溶液的溶质质量分数为:
 ×100%=15.3%.
×100%=15.3%.答:(1)生成铜的质量为6.4g;(2)硫酸铜溶液中溶质的质量分数16%;(3)反应后所得溶液的溶质质量分数为15.3%.
分析:(1)(2)先根据铁与硫酸铜反应的方程式以及铁的质量,列比例式即可求得反应生成的铜、硫酸铜以及硫酸亚铁的质量;
(3)根据质量守恒定律求得反应后溶液的质量,利用
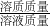 ×100%即可求得反应后所得溶液的溶质质量分数.
×100%即可求得反应后所得溶液的溶质质量分数.点评:本题考查了质量分数的计算以及根据化学方程式的简单计算,写好化学方程式是解题的关键.注意化学变化都遵循质量守恒定律,质量守恒定律的灵活使用,对于解答此类问题会有很大帮助,甚至起到决定性作用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关溶液中溶质质量分数的说法正确的是( )
| A、取食盐4.5g,水495.5g,可配成医疗用生理盐水,它的溶质质量分数为0.9% | B、在100g水中溶解20g食盐÷所得溶液的溶质质量分数为20% | C、100g硫酸铜溶液中含有17g硫酸铜,若再往其中加入1g无水硫酸铜,并使其完全溶解,则溶质质量分数变为18% | D、从溶质质量分数为20%的100g碳酸钠溶液中取10g溶液,则取出的溶液的溶质质量分数为2% |
 (2013?蒙山县二模)往100g硫酸铜溶液中滴加氢氧化钠溶液,产生沉淀的质量如图所示,回答下列问题
(2013?蒙山县二模)往100g硫酸铜溶液中滴加氢氧化钠溶液,产生沉淀的质量如图所示,回答下列问题