题目内容
某校研究性学习小组在实验室中,要用未知溶质质量分数的硫酸铜溶液测定一种含杂质的铁的纯度.他们的做法是用1.5g含杂质的铁,加入100g硫酸铜溶液中恰好完全反应,得到99.8g溶液.请帮助他们计算:
(1)参加反应的铁的质量是多少克?
(2)硫酸铜溶液中溶质的质量分数是多少?
解:设参加反应的铁的质量为x,硫酸铜质量为y
Fe+CuSO4═FeSO4+Cu 溶液质量减少
56 160 64 8
x y l00g-99.8g=0.2g
(1)
x=1.4g
(2)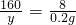
y=4g
硫酸铜溶液中溶质的质量分数=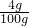 ×l00%=4%
×l00%=4%
答:(1)参加反应的铁的质量为1.4g
(2)硫酸铜溶液中溶质的质量分数为4%
分析:根据反应前后溶液的质量求出反应物和生成物的质量,根据化学方程式求出参加反应的铁和硫酸铜的质量进一步可求得硫酸铜溶液中溶质的质量分数
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度较大.
Fe+CuSO4═FeSO4+Cu 溶液质量减少
56 160 64 8
x y l00g-99.8g=0.2g
(1)

x=1.4g
(2)
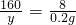
y=4g
硫酸铜溶液中溶质的质量分数=
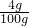 ×l00%=4%
×l00%=4%答:(1)参加反应的铁的质量为1.4g
(2)硫酸铜溶液中溶质的质量分数为4%
分析:根据反应前后溶液的质量求出反应物和生成物的质量,根据化学方程式求出参加反应的铁和硫酸铜的质量进一步可求得硫酸铜溶液中溶质的质量分数
点评:本题主要考查有关化学方程式的计算和溶质质量分数的计算,难度较大.

练习册系列答案
相关题目
逻辑推理是化学学习常用的思维方法.某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率.于是,他们对此展开探究:
(1)提出问题:什么物质是该反应催化剂?
(2)设猜想与假设:下面是组内两位同学所作的猜想,请你完成小华的猜想.
假设一:小芳同学:铁钉表面的氧化铁是H202溶液分解反应的催化剂.
假设二:小华同学:铁钉里的 是H202溶液分解反应的催化剂.
(3)实验与结论:
(4)讨论交流:
同学们讨论后认为,小芳的“实验I”还不能够确切的说明氧化铁就是过氧化氢分解制取氧
气的催化剂,理由是: .
请你设计实验(写出实验步骤、实验现象及结论)证明其中的某一点理由: .
(5)反思与评价:
小强通过仔细观察发现“实验Ⅱ”中一直没有现象的试管,过了一段时间后试管中也出现了气体,小强觉得很奇怪,你能猜想其中的原因吗? .
(1)提出问题:什么物质是该反应催化剂?
(2)设猜想与假设:下面是组内两位同学所作的猜想,请你完成小华的猜想.
假设一:小芳同学:铁钉表面的氧化铁是H202溶液分解反应的催化剂.
假设二:小华同学:铁钉里的
(3)实验与结论:
实验操作 |
实验现象 | 实验结论 |
| 实验Ⅰ:把一定质量的氧化铁粉末加入到装有10 mL5%的过氧化氢溶液的试管中,并用一根带火星的小木条置于试管口,观察现象. | 反应的化学方程式为: 假设一成立 | |
| 实验Ⅱ:取10 mL5%的过氧化氢溶液于另一支试管中,加入 |
无现象 |
假设二 (填“成立”或“不成立”) |
同学们讨论后认为,小芳的“实验I”还不能够确切的说明氧化铁就是过氧化氢分解制取氧
气的催化剂,理由是:
请你设计实验(写出实验步骤、实验现象及结论)证明其中的某一点理由:
(5)反思与评价:
小强通过仔细观察发现“实验Ⅱ”中一直没有现象的试管,过了一段时间后试管中也出现了气体,小强觉得很奇怪,你能猜想其中的原因吗?