题目内容
【题目】某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
(1)写出该中和反应的化学方程式_____。
(2)探究烧杯内溶液中溶质的成分。
[提出问题]该烧杯内溶液中的溶质是什么?
[猜想]
猜想一:可能是CaCl2和Ca(OH)2;
猜想二:可能只有CaCl2;
猜想三:_____。
[查阅资料]氯化钙溶液呈中性。
[进行实验]
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡;
实验现象:溶液不变红色,结论:猜想一_____(填“正确”或“不正确”);
实验步骤:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量;
实验现象:_____,结论:猜想二不正确,猜想三正确;
[反思与拓展]
①在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否过量;
②根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?_____(填序号)
a.pH试纸 b.铜 c.紫色石蕊溶液 d.硝酸银溶液
③烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是_____(写一条),要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的_____。
【答案】![]() 可能是CaCl2和HCl 不正确 先有气体产生,后产生沉淀 ac 腐蚀铁质下水管(或污染水源) 石灰石(或CaCO3)
可能是CaCl2和HCl 不正确 先有气体产生,后产生沉淀 ac 腐蚀铁质下水管(或污染水源) 石灰石(或CaCO3)
【解析】
(1)氢氧化钙和盐酸反应生成了氯化钙和水,因此反应的方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
[猜想] 反应可能是恰好反应,只有氯化钙、也可能是一种物质完全反应,另一种物质有剩余,若氢氧化钙过量,则含有氢氧化钙和氯化钙;若盐酸过量,则含有盐酸和氯化钙;
[进行实验] 取少量烧杯内溶液于试管中,滴入几滴酚酞溶液;溶液不变红色,说明反应后的溶液不呈碱性,所以猜想一不正确;
根据结论猜想二不正确,猜想三正确,即含有盐酸和氯化钙,其中的氯化钙溶液可以和碳酸钠溶液反应生成沉淀,稀盐酸和碳酸钠反应生成二氧化碳气体,因为碳酸钙在盐酸存在的情况下不能以沉淀的形式析出,故碳酸钠先和盐酸反应产生气泡,再和氯化钙反应产生沉淀;
[反思与拓展] ②因为烧杯内溶液中的溶质含有HCl显酸性,故用pH试纸测定pH应该小于7,能够使紫色的石蕊试液变成红色,但不能和排在氢后面的铜反应,虽然能够和硝酸银反应产生沉淀,但由于其中的氯化钙也能够和硝酸银产生相同的现象,不能选择;
③废液呈酸性,会腐蚀铁质下水管(或污染水源);除去溶液中的盐酸可用适量的碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳。

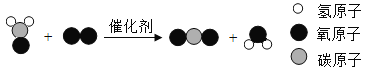
【题目】我校化学兴趣小组就空气中氧气的含量进行实验探究:
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择(填编号)_______
A 蜡烛 B 红磷 C 硫粉
为了充分消耗容器中的氧气,药品的用量应保证______。
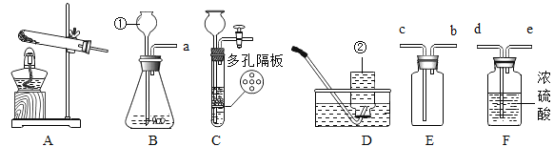
(2)小组同学共同设计了如图的两套装置,你认为合理的是(填编号)________。

[分组实验] 在讨论的基础上,他们分组进行了实验。
[数据分析] 实验结束后,整理数据如下:(注:集气瓶容积为100mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的____________。通过实验还可以推断集气瓶中剩余气体的化学性质是__________________。
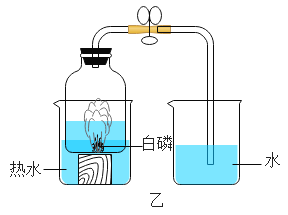
某同学对实验进行反思后,提出了改进方法(如图乙所示 ),你认为改进后的优点是:_________(写一点即可)。
【题目】从硅的氧化物可以制取硅单质,主要化学反应如下:
粗硅的制取:SiO2(石英砂)+2C(焦炭)![]() Si(粗硅)+2CO↑
Si(粗硅)+2CO↑
由粗硅制纯硅(常用方法):Si(粗)+2Cl2![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si(纯)+4HCl
Si(纯)+4HCl
(1)根据上述信息,请补全制取纯硅的简易流程图:________ .
![]()
(2)根据已有知识和上述信息,进行总结归纳:
①完成置换反应的通式:单质(I)+化合物(I)=单质(Ⅱ)+________ .
②填写下表:
单质(I) | 单质(Ⅱ) | 相应的置换反应的化学方程式(各一例) | |
A | 金属 | 非金属 | Fe+2HCl=FeCl2+H2↑ |
B | 金属 | 金属 | ________ [单质(I)为铜] |
C | ________ | ________ | ________ |
D | ________ | 金属 | H2+CuO |