题目内容
【题目】Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ |
NaOH溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
(1)实验________(填实验编号)中硫酸镁完全反应。
(2)100g混合溶液中含MgSO4的质量为___(写出计算过程)。
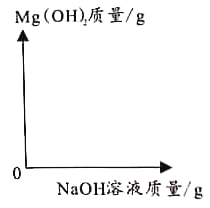
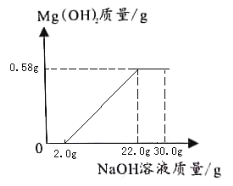
(3)分析实验数据,在下图中,画出加入4%NaOH溶液质量0—30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值_____。
【答案】③④ 1.2g 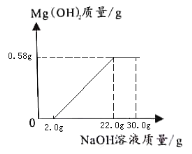
【解析】
(1)由实验数据表可知,实验③④中Mg(OH)2质量的不再发生变化,因此可知硫酸镁已经完全反应。故填:③④
(2)计算硫酸镁的质量应选择完全反应的组别来进行计算,因此可选用③④组数据进行计算,设溶液中硫酸镁的质量为x,消耗的氢氧化钠溶液的质量为y。

![]()
x=1.2g,y=20g;故填:1.2g
(3)由实验数据可知,设硫酸消耗的NaOH溶液的质量为z。假设溶液中没有硫酸,则全部氢氧化钠与硫酸镁反应,由数据分析可得,生成的氢氧化镁的质量减少了0.522g-0.232g-0.232g=0.058g,因此这部分没有与硫酸镁反应的氢氧化钠与硫酸发生了反应,假设与硫酸反应的氢氧化钠溶液的质量为z。
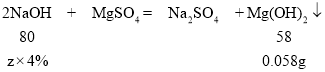
![]()
z=2g
一开始是氢氧化钠与硫酸反应没有沉淀产生,消耗了2.0gNaOH溶液,硫酸反应完之后,氢氧化钠与硫酸镁反应,开始产生沉淀,至硫酸镁完全反应,不再产生沉淀,根据氢氧化镁的质量求出氢氧化钠的质量为20.0g,当加入NaOH溶液的质量为20.0g+2.0g=22.0g;硫酸镁已完全反应;根据数据可以画出加入4%NaOH溶液质量0—30.0g过程中,产生Mg(OH)2沉淀质量对应的变化如图:

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】铁与水蒸气在高温条件下反应生成了一种铁的氧化物和一种气体单质,实验装罝如下图所示。
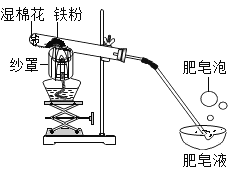
(1)试管尾部放一团湿棉花的目的是__________。
(2)用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到上方空气中。说明生成的气体是__________。
(3)探宄试管中剩余固体的成分。
(査阅资料)
①几种常见铁的氧化物的颜色、状态及能否被磁铁吸引如下表所示。
常见铁的氧化物 | FeO | Fe2O3 | Fe304 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色品体 |
能否被磁铁吸引 | 否 | 否 | 能 |
②四氧化三铁能与稀硫酸反应:
Fe304+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步实验验证)
试管中剩余间体为黑色,能全部被磁铁吸引,则剩余固体一定不含氧化物__________、__________。
(猜想与假设)
猜想一:剩余固体是Fe304;
猜想二:剩余固体是__________。
(继续进行实验)
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,滴加足量的稀硫酸。 | _____________。 | 猜想一不成立, 猜想二成立。 |
(实验结论)铁和水蒸气反应的化学方程式为____________________。