题目内容
在工业上用纯碱和石灰石为原料制备烧碱,主要流程如图所示: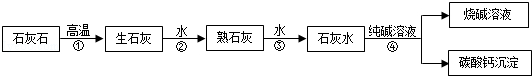
(1)在①﹣④四个过程中,发生了分解反应的是 (填序号).
(2)检验烧碱溶液中含有少量Na2CO3的具体方法是 .
(3)在室温下,将53g质量分数为10%的Na2CO3溶液与3000g澄清石灰水充分混合,恰好完全反应.则这时所得NaOH溶液的质量是多少?(计算结果精确至0.1g)
【答案】
(1)①
(2)取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠
(3)3048.0g
【解析】
试题分析:(1)碳酸钙在高温下生成氧化钙和二氧化碳,属于分解反应;氧化钙和水反应生成氢氧化钙,属于化合反应;氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,属于复分解反应;故填:①;
(2)因Na2CO3能与稀盐酸反应产生二氧化碳气体,在溶液中有气泡冒出,现象明显,可选稀盐酸,具体操作为:取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠;故答案为:取适量溶液于试管中,滴加稀盐酸,若有气泡产生,则说明含有碳酸钠;
(3)解:设生成碳酸钙的质量为y,
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
106 100
53g×10% y
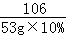 =
=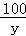 y=5g
y=5g
所以NaOH溶液的质量为:53g+3000g﹣5g=3048.0g.
考点:碳酸钙、生石灰、熟石灰之间的转化;盐的化学性质;分解反应及其应用;根据化学反应方程式的计算.
点评:本题考查了根据反应的流程完成反应原理及基本反应类型的判断、碳酸根离子的检验及相关的计算,根据碳酸钙离子的检验方法及化学方程式的计算即可完成.

练习册系列答案
相关题目

 工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠,化验员对每批刚生产出的纯碱产品都要进行检测,标出各种成分的含量后投放市场.在实验室用图Ⅰ所示装置组合进行测定(假设装置气密性良好,各装置均能吸收完全;碱石灰是氧化钙和氢氧化钠的混合物),取11.3g 该样品于A装置中,向其中逐滴加入溶质的质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图Ⅱ所示,请根据题意回答问题:
工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠,化验员对每批刚生产出的纯碱产品都要进行检测,标出各种成分的含量后投放市场.在实验室用图Ⅰ所示装置组合进行测定(假设装置气密性良好,各装置均能吸收完全;碱石灰是氧化钙和氢氧化钠的混合物),取11.3g 该样品于A装置中,向其中逐滴加入溶质的质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图Ⅱ所示,请根据题意回答问题: