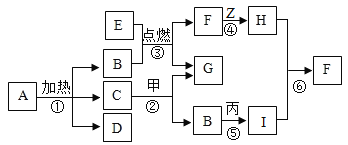
题目内容
【题目】溶液与人类生产、生活密切相关。请回答下列问题:
(1)打开汽水瓶盖汽水自动喷出,这说明气体在水中的溶解度与_____有关。
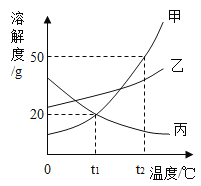
(2)甲、乙、丙三种固体物质(不含结晶水,且不与水反应)的溶解度曲线如下图所示。
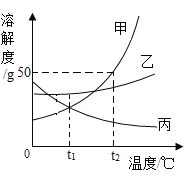
①t2℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是_____。
②t2℃时,把50g甲放入50g水中能得到甲的饱和溶液,其中溶质与溶液的质量比为_____。
③将丙的饱和溶液变为不饱和溶液,若保持溶液质量不变,可以采用_____方法。
④t2℃时,甲、乙、丙三种物质的饱和溶液降温至t1℃时,这三种溶液的溶质质量分数由大小关系是_____。
(3)向一定质量溶质质量分数为20%的硝酸钾溶液中同时加入4g硝酸钾和16g水所得的溶液中溶质质量分数为_____。
【答案】压强 甲>乙>丙 1:3 降温 乙>甲>丙 20%
【解析】
(2)①溶解度曲线上一点的纵坐标表示该点对应温度下此物质的溶解度大小,据此分析;
②溶液质量=溶质质量+溶剂质量,据此分析。
(1)打开汽水瓶盖汽水自动喷出,这说明气体在水中的溶解度与压强有关,打开瓶盖后,压强减小,则二氧化碳的溶解度减小,因此汽水自动喷出;
(2)①由溶解度曲线可知,t2℃时,甲、乙、丙三种物质对应的溶解度曲线上的点的纵坐标大小关系为:甲>乙>丙,因此t2℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:甲>乙>丙;
②由溶解度曲线可知,t2℃时,甲的溶解度大小为50g,因此把50g甲放入50g水中能得到甲的饱和溶液,该溶液的组成为:溶剂质量为50g,溶质质量为25g,则溶液质量=50g+25g=75g,因此溶质与溶液的质量比=25g:75g=1:3;
③丙的溶解度大小随温度的降低而增大,因此将丙的饱和溶液变为不饱和溶液,若保持溶液质量不变,可以采用降温的方法;
④甲、乙的溶解度随温度降低而减小,丙的溶解度随温度降低而增大,所以分别将t2℃时三种物质的饱和溶液降温至t1℃,甲、乙析出晶体,溶质的质量分数减小,丙溶解度变大,溶质的质量分数与降温前相等,饱和溶液中,溶质的溶解度越大则溶质质量分数也就越大,而t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,故所得溶液中溶质的质量分数的大小关系为乙>甲>丙;
(3)向一定质量溶质质量分数为20%的硝酸钾溶液中同时加入4g硝酸钾和16g水所得的溶液中溶质质量分数,可看作是原20%的硝酸钾溶液中,加入溶质是4g、溶剂是16g的溶液,加入的溶液的溶质质量分数=4g÷(4g+16g)×100%=20%。

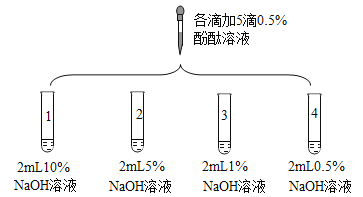
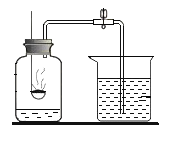
【题目】众所周知,酚酞溶液遇![]() 溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
溶液变红。但是,在分组实验中(如图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。

(提出问题)分组实验中,出现意想不到的现象的原因是什么呢?
(查阅资料)酚酞溶液由酚酞固体溶于酒精配制而成。
(猜想与假设)
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
(进行实验)
实验 | 实验操作 | 实验现象 | |
1 | 向盛有2mLNa2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 | |
2 |
| 1号试管 2号试管5min红色褪去 3号试管30min红色明显变浅 4号试管120min红色无明显变化 | |
3 | 取3支试管,分别加入2mL水,…… | 酚酞溶液浓度/% | 浑浊程度 |
5 | 大量浑浊物 | ||
2 | 少量浑浊物 | ||
| 无浑浊物 | ||
(解释与结论)
(1)NaOH与CO2反应的化学方程式为_______。
(2)实验1的现象表明,猜想与假设1____(填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是___。
(4)实验3的操作步骤:取3支试管,分别加入![]() 水,____。
水,____。
(反思与评价)
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为0.5%,建议选用NaOH溶液的浓度为____%。
【题目】下表中所描述的变化与右图相符合的是
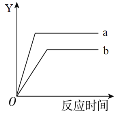
化学变化 | Y轴 | a | b | |
A | 等质量的高锰酸钾和水在不同条件下分解 | 氧气质量 | 高锰酸钾 | 水 |
B | 等质量、等浓度的双氧水在不同条件下反应 | 氧气质量 | 加催化剂 | 加热 |
C | 等质量的镁片和铁片分别与足量的稀硫酸反应 | 氢气质量 | 镁 | 铁 |
D | 等质量的二氧化碳和生石灰分别与等量的水反应 | 温度 | 二氧化碳 | 生石灰 |
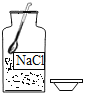
【题目】分类、类比、模仿都是学习化学常用的方法。
(1)不规范的实验操作会影响实验结果的准确性。下列是一些实验中常见的错误操作:
实验内容 |
|
|
|
|
A.测定空气中氧气的体积分数 | B.测NaOH溶液的pH | C.配制一定质量分数的氯化钠溶液 | D.蒸发食盐水 | |
错误操作 | 红磷的量不足 | 用蒸馏水润湿pH试纸 | 有一 部分溶剂酒到烧杯外 | 未等完全 蒸干就将产品转移到天平上 |
按照这些错误操作对“氧气的体积分数、溶液的pH、溶液的浓度、精盐的产率”四个实验结果的影响,可以将_____(填字母)归为一类,理由是这些操作都会使实验结果_____(选填“变大”、“变小”或“不变”)。
(2)在金属活动性顺序中,很活泼的金属投入CuSO4溶液中会发生如下反应:
以钠为例: ![]()
![]()
最后总反应的化学方程式可写为: ![]()
请你判断:总反应的化学方程式_____(填“是”或“不是" )置换反应。请你模仿金属钠与水的反应,写出金属钙与水反应的化学方程式_____。