题目内容
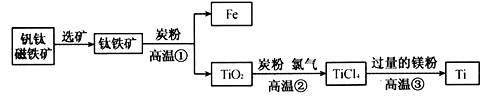
钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.在常温下钛和许多非金属、酸不反应,红热时,却可与许多常见非金属单质反应.钛是航空、宇航、军工、电力等方面的必须原料.地壳中的含钛矿石之一的TiO2称为金红石,目前大规模生产钛的方法是:
第一步:把金红石、炭粉混合,在高温条件下通入氯气(Cl2)制得TiCl4和一种可燃性气体,这一步发生反应的化学方程式是________.
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛.反应的化学方程式:2Mg+TiCl4![]() 2MgCl2+Ti.为什么该反应要在氩气的气氛中进行?
2MgCl2+Ti.为什么该反应要在氩气的气氛中进行?
第三步:把第二步反应所得的混合物在常温下用盐酸处理,过滤,即得到金属钛.发生反应的化学方程式是________,滤液中含有的溶质是________.
答案:
解析:
解析:
|
TiO2+2C+2Cl2 氩气性质不活泼,可保护金属镁,防止Mg在高温下被氧气氧化 Mg+2HCl=MgCl2+H2↑ MgCl2 |

练习册系列答案
相关题目
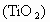 ,目前大规模生产钛的方法是:
,目前大规模生产钛的方法是:
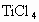 和一种可燃性气体,该步发生反应的化学方程式是_________________,该反应的还原剂是_______________.
和一种可燃性气体,该步发生反应的化学方程式是_________________,该反应的还原剂是_______________.