题目内容
金属钛(Ti)因为具有许多神奇的性能越来越引起人们的关注,被誉为“未来金属”。常温下钛不和非金属、强酸反应,加热至红热时,能与常见的非金属反应。工业上由钒钛磁铁矿提取金属钛的主要工艺过程如下:
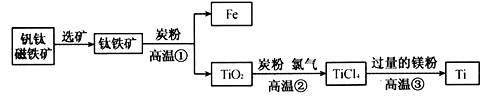
(1)钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价为____价。
(2)第②步反应中TiO2炭粉混合物在高温条件下通入氯气(Cl2)制得TiCl4和一种可燃性气体,该气体是_______。
(3)第③步反应是在氩气的环境中,用过量的镁在高温的条件下与TiCl4反应制得金属钛。此反应的化学方程式为______________,该反应属于____反应。
(4)如何在第③步反应后的产物中获得金属钛?
①主要的操作方法是__________;
②有关反应的化学方程式为___________________。
(2)第②步反应中TiO2炭粉混合物在高温条件下通入氯气(Cl2)制得TiCl4和一种可燃性气体,该气体是_______。
(3)第③步反应是在氩气的环境中,用过量的镁在高温的条件下与TiCl4反应制得金属钛。此反应的化学方程式为______________,该反应属于____反应。
(4)如何在第③步反应后的产物中获得金属钛?
①主要的操作方法是__________;
②有关反应的化学方程式为___________________。
(1)+4
(2)CO
(3)2Mg+TiCl4 2MgCl2+Ti;置换
2MgCl2+Ti;置换
(4)①向上述产物中加入足量盐酸(或稀硫酸),充分反应后过滤,洗涤,干燥。
②Mg+2HCl==MgCl2+H2↑(或Mg+H2SO4==MgSO4+H2↑)
(2)CO
(3)2Mg+TiCl4
 2MgCl2+Ti;置换
2MgCl2+Ti;置换(4)①向上述产物中加入足量盐酸(或稀硫酸),充分反应后过滤,洗涤,干燥。
②Mg+2HCl==MgCl2+H2↑(或Mg+H2SO4==MgSO4+H2↑)

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
| |||||||||||||||
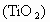 ,目前大规模生产钛的方法是:
,目前大规模生产钛的方法是:
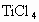 和一种可燃性气体,该步发生反应的化学方程式是_________________,该反应的还原剂是_______________.
和一种可燃性气体,该步发生反应的化学方程式是_________________,该反应的还原剂是_______________.
