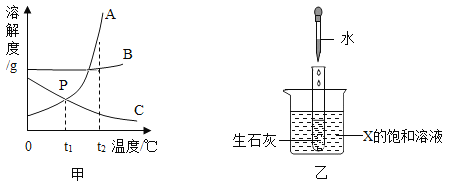
题目内容
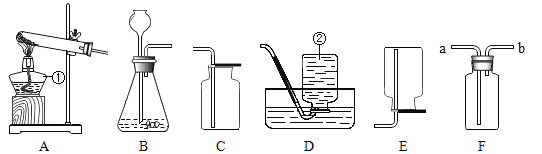
【题目】下图是实验室制取气体的常用装置,回答下列问题。
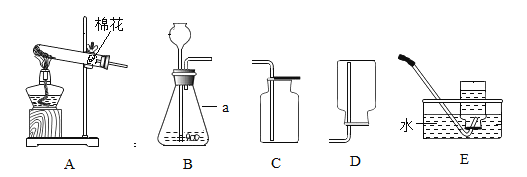
(1)写出图中标号仪器的名称:a________________________________;
(2)实验室用加热高锰酸钾的方法制取氧气,应选择的实验装置为_______________________________ ( 填序号):
(3)实验室用块状大理石和5%的稀盐酸反应制取CO2,用B作为发生装置。
①发生反应的化学方程式为________________________________;
②反应一段时间后,观察不到气泡产生,发现固体还有剩余,小明认为是盐酸已经完全反应或固体中已经没有碳酸钙。针对自己的猜想,小明进行如下探究(杂质不溶于水且不与酸反应)。
探究一:将液体倒出,向其中加入镁条,有气泡冒出,说明________________________________;
探究二:向剩余固体加入少量5%的稀盐酸,有气泡冒出,说明________________________________;
总结上述探究实验,可得出影响反应能否进行的因素之一是________________________________。
【答案】锥形瓶 AC或AE CaCO3+2HCl=CaCl2+H2O+CO2![]() 盐酸还有剩余 固体中还有碳酸钙 反应物的浓度
盐酸还有剩余 固体中还有碳酸钙 反应物的浓度
【解析】
高锰酸钾加热生成锰酸钾、二氧化锰和氧气,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,镁和稀盐酸反应生成氯化镁和氢气。
(1)图中标号仪器的名称:a是锥形瓶。
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,氧气密度比空气大,不易溶于水,用向上排空气法收集或排水法收集,实验室用加热高锰酸钾的方法制取氧气,应选择的实验装置为AC或AE。
(3) ①碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2![]() 。
。
②探究一:镁和稀盐酸反应生成氯化镁和氢气,将液体倒出,向其中加入镁条,有气泡冒出,说明盐酸还有剩余。
探究二:碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,向剩余固体加入少量5%的稀盐酸,有气泡冒出,说明固体中还有碳酸钙。
浓度越大,反应越容易进行,总结上述探究实验,可得出影响反应能否进行的因素之一是反应物的浓度。

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式_____。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我_____(“同意”或“不同意”)小明的观点,因为_____。
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色同体。
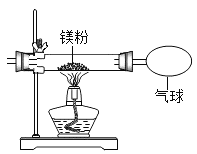
[提出问题]黄色固体是什么呢?
①氧化镁为白色同体
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
[做出猜想]黄色固体为Mg3N2
[实验探究]请设计实验,验证猜想:
实验操作 | 实验现象及结论 |
_____ | _____ |
[反思与交流]空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,为什么?请给出合理的解释_____。