题目内容
【题目】向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液.反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示,下列说法正确的是( )
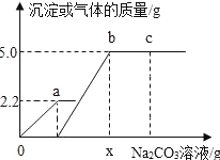
A. 图中oa段表示生成沉淀的质量
B. b点对应的溶液中溶质为2种
C. c点溶液的PH=7
D. X的值为106
【答案】D
【解析】
分析反应的过程可知:加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了,据此分析解答.
A、图中oa段表示生成的气体质量,故A选项错误;
B、b点表示碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质,故B选项错误;
C、c点的溶液中含有Na2CO3、NaCl两种溶质,由于Na2CO3显碱性,NaCl显中性,所以c的溶液的pH>7;故C选项错误;
D、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀5.0g.
设生成2.2g气体所需的Na2CO3的质量为y,生成沉淀5.0g所需Na2CO3的质量为z.则
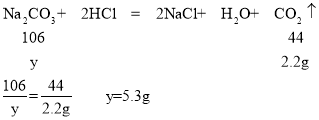
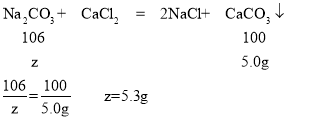
所以x=(5.3g+5.3g)÷10%=106g,故D选项正确。

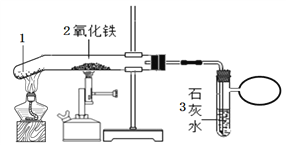
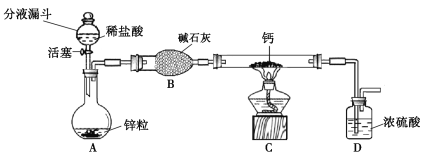
【题目】用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃.
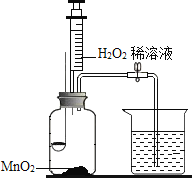
内容步骤 | (实验1)研究燃烧条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭点燃木炭后,迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为______;
(2)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均没燃烧,燃烧匙中白磷没燃烧是因为______,水中的白磷没燃烧是因为______;推入H2O2溶液后,观察到烧杯中的现象是______;
(3)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是______;木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.在实验2的整个过程中,集气瓶内压强的变化过程是______.
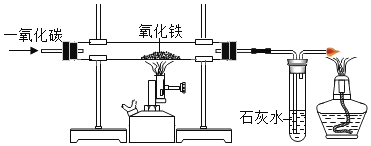
【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4,为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
(资料1)草酸晶体(H2C2O43H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O43H2O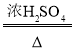 CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
(问题讨论)用如图所示装置进行实验:
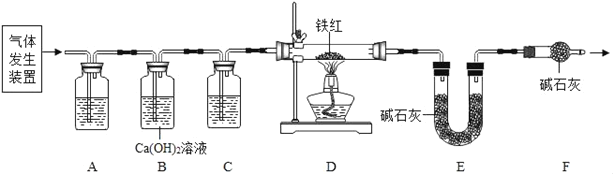
(1)实验前应先检查装置的气密性。
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是_____(填字母编号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是_____。
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸
②停止加热后_____。
(数据分析与计算)
(资料2)铁的常见氧化物中铁的质量分数
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(5)称取铁红样品10.0g用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为mg,则m的取值范围是_____。
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是_____。(计算结果精确到0.1%)
(实验评价)
(6)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会_____(填“偏小”、“不变”或“偏大”)。