��Ŀ����
����Ŀ�����ǵؿ��к�������Ԫ�أ������仯�����ǻ�ѧѧϰ���о�����Ҫ���ݡ�
��1������ͼ��ԭ�ӽṹʾ��ͼ�л�õ���Ϣ����ȷ����____�����ţ���
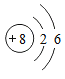
a�� ![]() ��ʾԭ�Ӻˣ���8����λ�����
��ʾԭ�Ӻˣ���8����λ�����
b����ԭ�Ӻ�����2�����Ӳ㣬��8�������ں����������˶�
c����ԭ���ڻ�ѧ��Ӧ����ʧȥ�����γ����ӣ�O2����
��2����������������___________��
��3����Ȼ������ѭ���Ļ���֮һ����ɫֲ��Ĺ�����ã��йط�Ӧ�Ļ�ѧ����ʽΪ��
![]() ����X��_______��
����X��_______��
��4��ˮ����Ҫ����������ˮʵ��˵��ˮ����__________��ɡ���ɽ��DZˮ����װ���У��ù������ƹ��壨Na2O2���������̼��Ӧ����̼���ƹ�����������÷�Ӧ�Ļ�ѧ����ʽΪ______��
���𰸡� a��b �����ӣ�O2�� 6 ��Ԫ�غ���Ԫ�� 2Na2O2 + 2CO2 === 2Na2CO3 + O2��
����������1��a��������ԭ�ӵĽṹʾ��ͼ��֪ԲȦ����ԭ�Ӻˣ�ԲȦ�ڵ����ִ�����������������Ϊ8����ȷ�� b��������ԭ�ӵĽṹʾ��ͼ��֪��ԭ����2�����Ӳ㡣��8�������ں����������˶�����ȷ�� c������ԭ�ӽṹʾ��ͼ���ص�ǽ���Ԫ�ص�����������һ�����4���ڻ�ѧ��Ӧ���õ������γ����ӣ�O2-��������
��2���������������������ӣ�
��3���ɷ���ʽ��֪����Ӧǰ̼ԭ����6������Ӧ����6������Ӧǰ��ԭ����12������Ӧ����12������Ӧǰ��ԭ����18������Ӧ��Ӧ����6+2x������x=6��
��4�����ˮ�������������������ˮʵ��˵��ˮ������Ԫ�غ���Ԫ����ɵģ��������ƺͶ�����̼��Ӧ����̼���ƺ��������÷�Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2CO2�T2Na2CO3+O2��

 �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�����Ŀ����7�֣�����������������ҽ����е�����ӵȹ�ҵ��ijʵ����ȤС��ӹ����ɼ���Һ����FeSO4������ZnSO4��MgSO4���������������������Ʊ�ʵ�顣
���Ķ����ϡ�
��1��25��ʱ���������������pH��Χ�����ʾ��
Zn��OH��2 | Fe��OH��2 | Mg��OH��2 | |
��ʼ������pH | 5.7 | 7.6 | 10.4 |
������ȫ��pH | 8.0 | 9.6 | 12.4 |
��2��25��ʱ��Zn��OH��2������pH��10.5�ļ���Һ��
��3���Ʊ�Fe3O4��ʵ���������£�
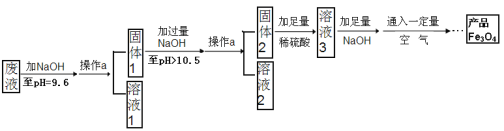
���ش����⡿
��1������Һ�м�������������Һ���ɳ����Ļ�ѧ����ʽΪ ��д������һ������
��2������a������Ϊ ���ò�����Ҫ�IJ����������ձ����������� �ȡ��������ڴ˲����е���Ҫ������ ��
��3����Һ1���������� ������д���ֳɷֵĻ�ѧʽ������Һ3�������ʵ���Ҫ�ɷ�Ϊ ��д���ƣ���